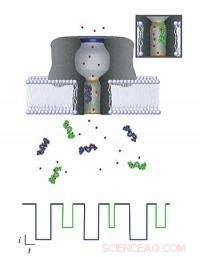
Varje molekyl som passerar genom nanoporen kan identifieras genom att övervaka förändringen den orsakar i en jonström som strömmar över membranet. När olika molekyler (lila och gröna föremål) kommer in i poren (grönt visas i infogning), var och en minskar strömmen med en viss mängd och tidsperiod (visas med motsvarande färgschema i det nuvarande diagrammet nedan), beroende på både dess storlek och förmåga att attrahera närliggande joner (röda prickar). NIST -modellen kan användas för att extrahera denna information, som kan användas för att identifiera och karakterisera biomarkörer för medicinska tillämpningar. Kredit:NIST
National Institute of Standards and Technology forskare har gått ett steg närmare att utveckla medel för ett snabbt diagnostiskt blodprov som kan söka efter tusentals sjukdomsmarkörer och andra kemiska indikatorer på hälsa. Teamet rapporterar att de har lärt sig hur man avkodar de elektriska signalerna som genereras av en nanopore - en "grind" som är mindre än 2 nanometer bred i ett artificiellt cellmembran.
Nanoporer är inte nya själva; i mer än ett decennium, forskare har försökt använda en nanopore-baserad elektrisk detektor för att karakterisera enkelsträngat DNA för genetiska sekvenseringstillämpningar. På senare tid, NIST -forskare riktade sin uppmärksamhet mot att använda nanoporer för att identifiera, kvantifiera och karakterisera var och en av de mer än 20, 000 proteiner kroppen producerar - en förmåga som skulle kunna ge en ögonblicksbild av en patients övergripande hälsa vid ett givet ögonblick. Men medan nanoporer tillåter molekyler att komma in i dem en i taget, att bestämma vilken specifik individuell molekyl som just har passerat har inte varit lätt.
För att lösa detta problem, medlemmar i NIST -teamet som tidigare utvecklat en metod för att skilja både storleken och koncentrationen på varje typ av molekyl som nanoporen medger har nu svarat på frågan om hur dessa enskilda molekyler interagerar med nanoporen. Deras nya teoretiska modell beskriver fysiken och kemin för hur nanoporen, i själva verket, analyserar en molekyl, en förståelse som kommer att främja användningen av nanoporer inom det medicinska området.
"Detta arbete ger oss ett steg närmare att förverkliga dessa nanoporer som ett kraftfullt diagnostiskt verktyg för medicinsk vetenskap, "säger Joseph Reiner, som utförde verket med Joseph Robertson, och John Kasianowicz, alla NIST:s Semiconductor Electronics Division. "Det lägger till" Rosetta Stone "som gör att vi kan läsa vilka molekyler som just har passerat genom en nanopor."
Med sina nya metoder, laget kunde modellera interaktionen mellan en viss typ av stor molekyl genom en nanopores öppning med stor noggrannhet. Molekylerna var polyetylenglykol (PEG), en välkänd polymer som bildar kedjor av varierande längd.
"PEG -kedjor kan vara väldigt långa, men varje länk är väldigt liten, "Kasianowicz säger." Det var ett bra test eftersom vi ville se om nanoporen kunde skilja mellan två nästan identiska stora molekyler som skiljer sig i längd med bara några atomer. "
Teamets enhet kunde enkelt skilja mellan PEG-kedjor av olika storlek, och modellen de har utvecklat för att beskriva PEG-nanopore-interaktioner uppmuntrar dem att tro att med ytterligare ansträngningar de små sensorerna kan anpassas för att snabbt mäta många olika molekyler. "Vi kan tänkas bygga en rad många nanoporer, var och en skapad för att mäta ett specifikt ämne, "Säger Kasianowicz." Eftersom varje nanopor är så liten, en matris med en för varje protein i kroppen skulle fortfarande vara liten. "