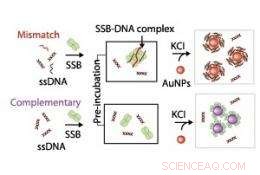
Schematisk illustration som visar mekanismen som används för att undersöka interaktioner mellan enkelsträngat DNA (ssDNA) och enkelsträngat DNA-bindande protein (SSB). Kredit:2011 ACS
Dubbelsträngat DNA måste lossna sig till enkla strängar under replikering eller reparation för att tillåta funktionella molekyler att binda och utföra sina olika operationer. Cellulära proteiner binder specifikt till enkelsträngat DNA för att förhindra deras förtida rekombination. Tyvärr, detaljerade studier av dessa DNA-proteininteraktioner har hindrats av behovet av dyr instrumentering och tidskrävande märkningstekniker. Yen Nee Tan vid A*STAR Institute of Materials Research and Engineering och medarbetare1 har nu utvecklat en bekväm metod för att karakterisera interaktionerna mellan enkelsträngat DNA och deras bindande proteiner.
Forskarna använde guldnanopartiklars optiska egenskaper för att undersöka mekanismen för protein-DNA-bindning. När nanopartiklarna var väl dispergerade i lösning, de gav en klar röd färg, men när det är aggregerat, lösningen ändrades till blå. Tan och medarbetare upptäckte att när enkelsträngat DNA och dess bindande protein båda fanns i lösningen, i kombination med ett salt som stimulerar aggregation av nanopartiklar, DNA förblev röd till färgen, vilket tyder på att DNA-proteinkomplexen hade bundit till nanopartiklarna genom elektrosteriska stabiliseringskrafter. I kontrast, när proteinet eller enkelsträngat DNA infördes ensamt i saltlösningen, det var en större förändring till den blågrå färgen, indikerar nanopartikelaggregation (se bild).
"Den största utmaningen i detta arbete var att bestämma de optimala förhållandena för enkelsträngat DNA att binda med sitt bindande protein för att bilda komplex som ger högsta stabilitet till guldnanopartiklar från saltinducerad aggregering, säger Tan.
Forskarna tillskriver bindning av nanopartiklarna och DNA-proteinkomplexen till närvaron av svavelhaltiga grupper i proteinet, som är kända för att skapa starka band med guld. Enbart proteinmolekylerna är mindre i molekylstorlek än protein-DNA-komplexen, leder till en mindre effektiv sterisk stabilisering av nanopartiklarna.
Tan och medarbetare visade att det fanns en minsta längd av DNA-sekvensen under vilken den bindande protein-DNA-vidhäftningsmekanismen kunde fungera. De fann att det bindande proteinet hade en preferens för att binda till specifika kemiska enheter (baser) som utgör DNA, och kunde upptäcka DNA-sekvensvariationer, kallas singelnukleotidpolymorfismer (SNP), även i de yttersta ändarna av molekylen som är svåra att identifiera. Dubbelsträngat DNA med SNP kan inte binda ihop så nära. Det bindande proteinet kan således fästa till det dissocierade enkelsträngade DNA:t för att bilda protein-DNA-komplex, erbjuda platser där guldnanopartiklar kan fästa.
"Vi planerar att vidareutveckla denna analys till en problemfri genotypningsanalys för att detektera SNP:er i riktiga biologiska prover som innehåller långt genomiskt DNA, säger Tan.