
En samling farmaceutiska molekyler visas efter självmontering. Detaljen visar en enda molekyl, består av DNA-strängar, ett terapeutiskt medel och andra komponenter som förbättrar dess förmåga att rikta cancer. Kredit:Parabon NanoLabs
(Phys.org)—Med ett enkelt "dra-och-släpp"-datorgränssnitt och DNA-självsammansättningstekniker, forskare har utvecklat ett nytt tillvägagångssätt för läkemedelsutveckling som drastiskt kan minska tiden som krävs för att skapa och testa mediciner.
I arbete som stöds av National Science Foundation (NSF) Small Business Innovation Research-anslag, forskare från Parabon NanoLabs of Reston, Va., nyligen utvecklat och började utvärdera ett läkemedel för att bekämpa den dödliga hjärncancern glioblastoma multiforme.
Nu, med stöd av ett NSF Technology Enhancement for Commercial Partnerships (TECP)-anslag, Parabon har samarbetat med Janssen Research &Development, LLC, en del av Janssen Pharmaceutical Companies of Johnson &Johnson, att använda tekniken för att skapa och testa effekten av ett nytt prostatacancerläkemedel.
"Vi kan nu skriva ut, ' molekyl för molekyl, exakt den förening vi vill ha, " säger Steven Armentrout, huvudutredaren för NSF:s bidrag och medutvecklare av Parabons teknologi. "Det som skiljer vår nanoteknik från andra är vår förmåga att snabbt, och precis, specificera placeringen av varje atom i en förening som vi designar."
Den nya tekniken kallas Parabon Essemblix Drug Development Platform, och den kombinerar deras datorstödda design (CAD) programvara som kallas inSçquio med nanoskala tillverkningsteknik.
Forskare arbetar inom inSçquio för att designa molekylära delar med specifika, funktionella komponenter. Programvaran optimerar sedan designen med hjälp av Parabon Computation Grid, en cloud supercomputing-plattform som använder egenutvecklade algoritmer för att söka efter uppsättningar av DNA-sekvenser som kan självmontera dessa komponenter.
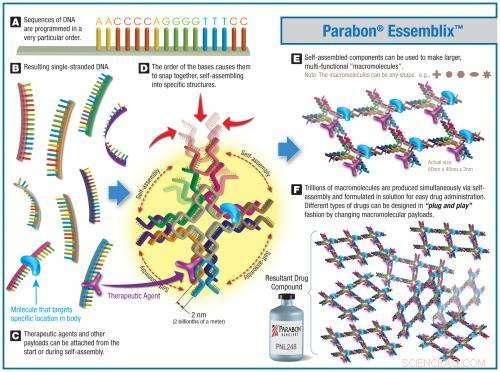
Den här illustrationen visar den nya Essemblix nanotillverkningsteknologi som utvecklats av Parabon NanoLabs med NSF-stöd. Kredit:Parabon NanoLabs
"När man designar en terapeutisk förening, vi kombinerar kunskap om de cellreceptorer vi riktar in oss på eller biologiska vägar vi försöker påverka med en förståelse för länkkemin som definierar vad som är möjligt att sätta ihop, säger Hong Zhong, senior forskare vid Parabon och en samarbetspartner på anslagen. "Det är en medveten och metodisk ingenjörsprocess, vilket skiljer sig ganska mycket från de flesta andra metoder för läkemedelsutveckling som används idag."
Med de resulterande sekvenserna, forskarna syntetiserar kemiskt biljoner identiska kopior av de designade molekylerna. Processen, från idé till produktion, kan utföras på veckor, eller till och med dagar – mycket snabbare än traditionella läkemedelsupptäckningstekniker som förlitar sig på trial and error för screening av potentiellt användbara föreningar.
In vivo experiment, finansierat av NSF SBIR-priset, validerade tillvägagångssättet, och Parabon lämnade in ett provisoriskt patent för sina metoder och föreningar den 4 maj, 2011. Den slutliga ansökan publicerades 2012.
Processen är karakteristisk för rationell drogdesign, ett försök att tillverka läkemedel baserat på kunskap om hur vissa molekylära delar kommer att fungera tillsammans i ett biologiskt system. Till exempel, vissa molekyler är bra på att hitta cancerceller, medan andra är bra på att fästa vid cancerceller, medan ytterligare andra är kapabla att döda celler. Att arbeta tillsammans som en del av en större molekyl, dessa bitar kan visa sig effektiva som en cancerbehandling.
Medan det finns andra metoder för att skapa flerkomponentföreningar, de tar vanligtvis längre tid, och, Viktigast av allt, majoriteten av dem saknar exakt kontroll över storleken, laddning och den relativa placeringen av komponenter som möjliggörs av den nya tekniken. Det senaste TECP-bidraget gav ett komplement till Parabon för att stödja ytterligare forskning som kommer att hjälpa de nya teknologierna att möta marknadens krav.
TECP-bidrag är en mekanism som är tillgänglig för NSF Fas II SBIR/STTR-bidragstagare, hjälpa till att förbättra deras kommersiella framgång genom att göra det möjligt för dem att bygga partnerskap med större företag och investerare. Dessa partners kräver i allmänhet nya produkter för att uppfylla fastställda specifikationer och standarder, och TECP kompletterande utmärkelser tillhandahåller finansiering för den forskning som krävs för att uppfylla dessa parametrar. Som med Parabon och Janssen, de företag som samarbetar med TECP-stipendiater ger input som hjälper till att vägleda den tekniska utvecklingen ytterligare.
"Partnerskap är erkänt som en kritisk framgångsfaktor för småföretag som kommersialiserar teknologi, " säger Ruth Shuman, NSF-programdirektören som övervakar NSF TECP-insatsen. "Dock, potentiella partners kräver ofta tekniska specifikationer och kräver proof-of-concept-data som en förutsättning för partnerskap, krav som ligger utanför räckvidden för småföretagens ursprungliga mål. Denna tilläggsfinansiering gör det möjligt för små företag att bedriva ytterligare forskning för att uppfylla kraven från en företagspartner, potentiellt leda till kommersiella produkter och tjänster, och ett framgångsrikt partnerskap."
Forskarna i Parabon och Janssen avser att med deras nya prostatacancerläkemedel övervinna flera befintliga cancerbehandlingshinder. Läkemedelsdesignen kombinerar ett toxin med en kemikalie som gör cancerceller mottagliga för det toxinet. Dessutom, läkemedlet innehåller komponenter som förbättrar leveransen till cancerceller samtidigt som frisk vävnad undviks, och kemiska markörer som gör det möjligt för forskare att övervaka läkemedlets ankomst till tumörer. För den nya föreningen, total designtid plus syntestid kommer att vara en fråga om veckor.
"För närvarande, de flesta läkemedel utvecklas med hjälp av en screeningteknik där man provar många kandidatsubstanser mot mål för att "se vad som fastnar", " säger Armentrout. "Istället, vi designar mycket specifika läkemedel baserat på deras molekylära struktur, med målmolekyler som binder till receptorer på specifika typer av cancerceller. På plug-and-play-sätt, vi kan byta in eller byta ut någon av de funktionella komponenterna, efter behov, för en rad olika behandlingsmetoder."
Samtidigt Parabon utvecklar andra applikationer för tekniken, inklusive syntetiska vacciner för bioförsvar och genterapier som kan rikta in sig mot sjukdomar, baserat på information från en individs arvsmassa. Tekniken har även tillämpningar utanför medicinen, och Parabons medgrundare Chris Dwyer och Michael Norton bygger på det initiala NSF-stödda arbetet med att utveckla processer för att skapa logiska grindar i nanoskala, enheter som är viktiga för datorer, och molekylära nanosensorer.