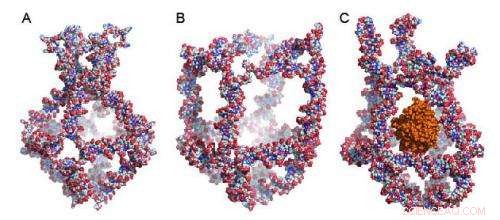
Figuren visar en nanocage där åtta unika DNA-molekyler blandas ihop. Nanocage har fyra funktionella element som omvandlar sig själva som svar på förändringar i den omgivande temperaturen. Dessa transformationer stänger antingen (1A) eller öppnar (1B) nanocage. Genom att utnyttja temperaturförändringarna i omgivningen, forskarna fångade ett aktivt enzym som kallas pepparrotsperoxidas (HRP) i nanocage (1C). Kredit:Sissel Juul
En nanorobot är en populär term för molekyler med en unik egenskap som gör att de kan programmeras för att utföra en specifik uppgift. I samarbete med kollegor i Italien och USA, forskare vid Aarhus Universitet har nu tagit ett stort steg mot att bygga den första nanoroboten av DNA-molekyler som kan kapsla in och frigöra aktiva biomolekyler.
I tid, nanoroboten (även kallad DNA nanocage) kommer utan tvekan att användas för att transportera mediciner runt i kroppen och därigenom ha en riktad effekt på sjuka celler.
Designa med hjälp av kroppens naturliga molekyler
Genom att använda DNA-självmontering, forskarna designade åtta unika DNA-molekyler från kroppens egna naturliga molekyler. När dessa molekyler blandas ihop, de aggregerar spontant i en användbar form – nanocage (se figur).
Nanocage har fyra funktionella element som omvandlar sig själva som svar på förändringar i den omgivande temperaturen. Dessa transformationer antingen stänger (figur 1A) eller öppnar (figur 1B) nanocage. Genom att utnyttja temperaturförändringarna i omgivningen, forskarna fångade ett aktivt enzym som kallas pepparrotsperoxidas (HRP) i nanocage (figur 1C). De använde HRP som modell eftersom dess aktivitet är lätt att spåra.
Detta är möjligt eftersom nanocagens yttre galler har öppningar med en mindre diameter än den centrala sfäriska håligheten. Denna struktur gör det möjligt att kapsla in enzymer eller andra molekyler som är större än öppningarna i gittret, men mindre än den centrala kaviteten.
Forskarna har precis publicerat dessa resultat i den välrenommerade tidskriften ACS Nano . Här visar forskarna hur de kan utnyttja temperaturförändringar för att öppna nanocage och låta HRP kapslas in innan det stänger igen.
De visar också att HRP behåller sin enzymaktivitet inuti nanocage och omvandlar substratmolekyler som är tillräckligt små för att penetrera nanocage till produkter inuti.
Inkapslingen av HRP i nanocage är reversibel, på ett sådant sätt att nanocage kan släppa ut HRP en gång till som reaktion på temperaturförändringar. Forskarna visar också att DNA-nanocage – med sin enzymbelastning – kan tas upp av celler i kultur.
Med blicken mot framtiden, konceptet bakom denna nanocage förväntas användas för läkemedelsleverans, det vill säga som transportmedel för medicin som kan rikta in sig på sjuka celler i kroppen för att uppnå en snabbare och mer gynnsam effekt.