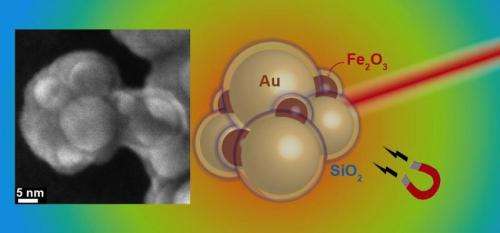
Schema av guld- och järnoxidaggregat med kiseldioxidskal. Vänster:elektronmikroskopisk bild av ett aggregat. Upphovsman:Georgios Sotiriou / ETH Zürich
Nanopartiklar har en stor potential inom medicin:för diagnostik, som ett medel för aktiva substanser eller ett verktyg för att döda tumörer med värme. ETH Zürichs forskare har nu utvecklat partiklar som är relativt enkla att tillverka och har ett brett användningsområde.
Om du lägger handen över en påslagen fackla i mörkret, det verkar lysa rött. Detta beror på att röda ljusstrålar med lång våglängd penetrerar mänsklig vävnad mer effektivt än blått ljus med kort våglängd. ETH Zürichs forskare utnyttjar detta faktum i en ny typ av nanopartiklar:så kallade plasmoniska partiklar, som värms upp när de absorberar nära-infrarött ljus. Detta kan göra det möjligt för dem att döda tumörvävnad med värme, till exempel.
Guld är ett populärt material för nanopartiklar som används terapeutiskt, eftersom det tolereras väl och vanligtvis inte utlöser några oönskade reaktioner. I den karakteristiska boll- eller sfärformen av nanopartiklar, dock, guld har inte de egenskaper som krävs för att fungera som en plasmonisk partikel som absorberar tillräckligt i det nära infraröda ljusspektrumet för att värma upp. Att göra så, det måste formas till en speciell form, som en stång eller skal, så att guldatomerna antar en konfiguration som börjar absorbera nära-infrarött ljus, vilket genererar värme. Att producera sådana nanoroder eller nanoskal i tillräckliga mängder, dock, är komplex och dyr.
Aggregat istället för stavar
Ett team av forskare som leds av Sotiris Pratsinis, Professor i partikelteknik vid ETH Zürich, har nu upptäckt ett knep för att tillverka plasmoniska guldpartiklar i stora mängder. De använde sitt befintliga kunnande om plasmoniska nanopartiklar och tillverkade sfärformade guldnanopartiklar som visar de önskade nära-infraröda plasmoniska egenskaperna genom att låta dem aggregeras. Varje partikel är belagd med ett kiseldioxidskikt i förväg, som fungerar som en platshållare mellan de enskilda sfärerna i aggregatet. Genom det exakt definierade avståndet mellan flera guldpartiklar, forskarna omvandlar partiklarna till en konfiguration som absorberar nära-infrarött ljus och därmed genererar värme.
"Kiseldioxidskalet har en annan fördel", förklarar Georgios Sotiriou, första författare till studien och, tills nyligen, en postdoc i Pratsinis forskargrupp och för närvarande en Swiss National Science Foundation Fellow vid Harvard University:"Det hindrar partiklarna från att deformeras när de värms upp." Detta är ett stort problem med nanoroder. Om stavarna tappar formen under uppvärmning, de förlorar sina önskade plasmoniska egenskaper och kan inte längre absorbera tillräckligt nära infrarött ljus för att generera värme.
Forskarna har redan testat de nya partiklarna på bröstcancerceller i en petriskål och upptäckt att efter exponering för nära-infrarött ljus upphettades nanopartiklarna tillräckligt för att döda cellerna, medan celler överlevde i kontrollförsök (med partiklar men utan strålning och med strålning men utan nanopartiklar).
Kombination med stor potential
För att kunna styra partiklarna specifikt mot cancervävnad, forskarna blandade också in superparamagnetiska järnoxidpartiklar med guldpartiklarna, som gör att nanoaggregaten kan kontrolleras via magnetfält och kan öka deras ackumulering i en tumör. Dessutom, detta öppnar möjligheten att värma aggregaten i djupa vävnadsskikt som infrarött ljus inte längre kan nå via magnetisk hypertermi. Här, uppvärmningen av partiklarna induceras av ett magnetfält, där plus- och minuspolerna växlar i snabb takt.
"Många frågor måste fortfarande besvaras innan partiklarna kan användas hos människor", säger Jean-Christophe Leroux, Professor i läkemedelsformulering och leverans vid ETH Zürich, som också var engagerad i forskningsprojektet. Även om guld, kiseldioxid och järnoxid tolereras väl, vad som händer med partikelaggregaten i kroppen med tiden - oavsett om de ackumuleras i levern eller bryts ner och utsöndras, till exempel - behöver fortfarande undersökas.
Hybridjärnoxid-guld-nanopartiklarna kan inte bara döda bort tumörceller genom värme; de kan också användas som kontrastmedium för avbildningsprocesser inom diagnostik genom magnetisk resonansavbildning, som undersökts i samarbete med University Hospital Zürich, eller som en del av ett fordon som bär aktiva ämnen. "Du kan till och med koppla ihop partiklarna med temperaturkänsliga läkemedelsbärare, som sedan skulle möjliggöra frisättning av läkemedlet om en viss temperatur överskreds ", förklarar Sotiriou. Detta skulle tillåta att oönskade biverkningar på resten av kroppen minskas eller till och med undviks.