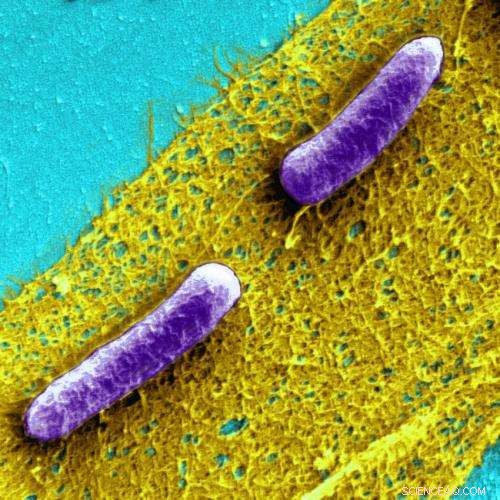
Biofilmer är samhällen av bakterier ( E coli är avbildade här i lila) inkapslade i en slemmig, men extremt seg matris av extracellulärt material. Kredit:Harvards Wyss Institute
För de flesta frammanar biofilmer bilder av hala stenar i en bäck och smutsiga avlopp. Även om det finns gott om "dåliga" biofilmer runt omkring – de orsakar till och med irriterande tandplack och en mängd andra allvarligare medicinska problem – ser ett team vid Wyss Institute for Biologically Inspired Engineering vid Harvard University biofilmer som en robust ny plattform för designade nanomaterial som kan rensa upp förorenade floder, tillverka farmaceutiska produkter, tillverka nya textilier, och mer.
Kortfattat, de vill ge biofilmer ett ansiktslyft, och har utvecklat ett nytt proteintekniksystem som kallas BIND för att göra det. Med BIND, som står för Biofilm-Integrated Nanofiber Display, teamet sa att biofilmer kan vara morgondagens levande gjuterier för storskalig produktion av biomaterial som kan programmeras för att tillhandahålla funktioner som inte är möjliga med befintliga material. De har rapporterat proof-of-concept i Naturkommunikation .
"Mest biofilmrelaterad forskning idag fokuserar på hur man blir av med biofilmer, men vi visar här att vi kan konstruera dessa supertuffa naturmaterial för att utföra specifika funktioner – så vi kanske vill ha dem runt om i specifika mängder och för specifika tillämpningar, "sade Wyss Institute Core Fakultetsmedlem Neel Joshi, Ph.D., studiens seniorförfattare. Joshi är också docent i kemi- och biologisk teknik vid Harvard School of Engineering and Applied Sciences (SEAS).
Biofilmer monteras också själv och läker sig själv. "Om de blir skadade, de växer direkt tillbaka eftersom de är levande vävnader, " sa huvudförfattaren Peter Nguyen, Ph.D., en postdoktor vid Wyss Institute och Harvard SEAS.
Biofilmer är samhällen av bakterier inneslutna i en slemmig, men extremt tuff, matris av extracellulärt material som består av sockerarter, proteiner, genetiskt material med mera. Under biofilmbildning pumpar enskilda bakterier ut proteiner som självbildar sig utanför cellen - skapar trassliga nätverk av fibrer som i huvudsak limmar ihop cellerna till samhällen som håller bakterierna säkrare än de skulle vara på egen hand.
Intresset för biofilmsteknik skjuter i höjden, och medan flera andra team nyligen har utvecklat genetiska verktyg för att kontrollera biofilmbildning, Joshis team ändrade sammansättningen av det extracellulära materialet i sig-i huvudsak förvandlade det till en självreplikerande produktionsplattform för att slänga ut vilket material de vill producera.
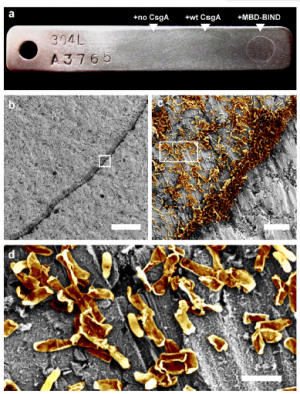
Joshis team har visat förmågan att programmera E coli biofilmer för att hålla fast vid vissa underlag, såsom rostfritt stål. De fusionerade ett protein som heter MBD med CsgA-proteinet för att utveckla en biofilm, som de lät fästa på stål under 48 timmar – och bekräftade sedan med hjälp av ett svepelektronmikroskop (SEM) att biofilmen klarade en kraftig tvättprocedur (som visas i c-d). Kredit:Harvard's Wyss Institute
"Tills nyligen fanns det inte tillräckligt samarbete mellan syntetiska biologer och biomaterialforskare för att utnyttja biofilmernas syntetiska potential på detta sätt. Vi försöker överbrygga den klyftan, " sa Joshi.
Teamet fusionerade genetiskt ett protein med en viss önskad funktion – till exempel, en känd för att fästa vid stål – på ett litet protein som kallas CsgA som redan produceras av E coli bakterie. Den bifogade domänen följde sedan med på resan genom den naturliga processen genom vilken CsgA utsöndras utanför cellen, där det självmonterats till supertuffa proteiner som kallas amyloid nanofibrer. Dessa amyloidproteiner behöll funktionen hos det tillsatta proteinet - vilket i detta fall säkerställde att biofilmen vidhäftade till stål.
Amyloidproteiner får traditionellt en dålig rap för sin roll i att orsaka enorma hälsoutmaningar som Alzheimers sjukdom, men i det här fallet är deras roll grundläggande för att göra BIND så robust. Dessa amyloider kan spontant samlas till fibrer som, efter vikt, är starkare än stål och styvare än silke.
"Vi är entusiastiska över metodens mångsidighet, för, " Sa Joshi. Teamet visade en förmåga att smälta samman 12 olika proteiner till CsgA-proteinet, med mycket varierande sekvenser och längder. Detta innebär i princip att de kan använda denna teknik för att visa praktiskt taget vilken proteinsekvens som helst – en viktig egenskap eftersom proteiner utför en rad imponerande funktioner från att binda till främmande partiklar till att utföra kemiska reaktioner, sända signaler, ge strukturellt stöd, och transport eller lagring av vissa molekyler.
Inte bara kan dessa funktioner programmeras in i biofilmen en i taget, men de kan kombineras för att skapa multifunktionella biofilmer också.
Konceptet med den mikrobiella fabriken är inte nytt, men för första gången appliceras det på material, i motsats till lösliga molekyler som droger eller bränslen. "Vi programmerar i huvudsak cellerna för att vara tillverkningsanläggningar, "Sa Joshi." De producerar inte bara en råvara som en byggsten, de orkestrerar sammansättningen av dessa block till strukturer av högre ordning och upprätthåller den strukturen över tid."
"Det grundläggande arbete Neel och hans team gör med biofilmer ger en inblick i en mycket mer miljömässigt hållbar framtid där gigantiska fabriker reduceras till storleken av en cell som vi kan programmera för att tillverka nya material som uppfyller våra vardagliga behov – från textilier till energi- och miljösanering, " sa Wyss Institutes grundare Don Ingber, M.D., Ph.D.
För närvarande har teamet visat förmågan att programmera E coli biofilmer som fastnar på vissa substrat, såsom stål, andra som kan immobilisera en mängd proteiner eller främja mallen av silver för konstruktion av nanotrådar.