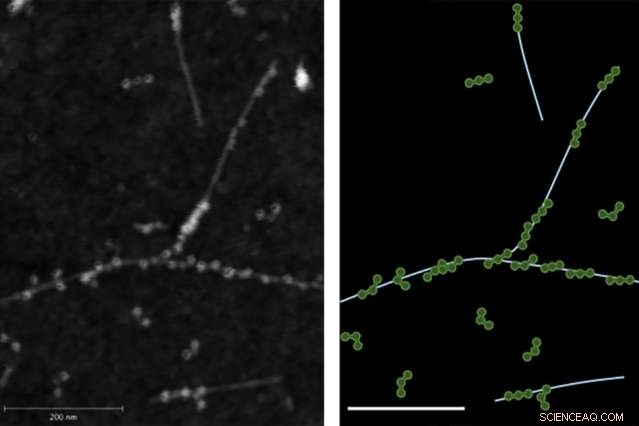
Atomkraftmikroskopi (AFM) -bilden till vänster visar den fysiska bindningen mellan fibrinogenproteiner och enväggiga kolnanorör. Till höger visas ett spår av AFM-bilden med fibrinogen i grönt och nanorör i ljusblått.
Med hjälp av kolnanorör, MIT -ingenjörer har tagit fram en ny metod för att upptäcka proteiner, inklusive fibrinogen, en av koagulationsfaktorerna som är kritiska för blodkoaguleringskaskaden.
Detta tillvägagångssätt, om den utvecklas till en implanterbar sensor, kan vara användbart för att övervaka patienter som tar blodförtunnande medel, tillåter läkare att se till att läkemedlen inte stör blodets koagulering för mycket.
Den nya metoden är den första att skapa syntetiska igenkänningsplatser (liknande naturliga antikroppar) för proteiner och koppla dem direkt till en kraftfull nanosensor som en kolnanorör. Forskarna har också gjort betydande framsteg när det gäller en liknande igenkänningsplats för insulin, vilket skulle kunna möjliggöra bättre övervakning av patienter med diabetes. Det kan också vara möjligt att använda detta tillvägagångssätt för att upptäcka proteiner associerade med cancer eller hjärtsjukdom, säger Michael Strano, Carbon P. Dubbs professor i kemiteknik vid MIT.
Strano är seniorförfattare till ett papper som beskriver metoden i Nature Communications. Gili Bisker, en postdoc i Stranos labb, är tidningens huvudförfattare.
En riktad sökning
Den nya sensorn är det senaste exemplet på en metod som utvecklats i Stranos labb, känd som Corona Phase Molecular Recognition (CoPhMoRe).

Denna svepelektronmikroskopbild visar enkelväggiga kolnanorör, utgångsmaterialet som forskarna använde.
Denna teknik drar fördel av interaktionerna mellan en given polymer och en nanopartikelyta, såsom den hos ett fluorescerande enkelväggigt kolnanorör, när polymeren lindas runt nanoröret.
Vissa områden av polymererna låser sig på nanopartikelytan som ankare, medan andra regioner sträcker sig utåt i sin miljö. Denna utåtvända region, även känd som den adsorberade fasen eller corona, har en 3D-struktur som beror på polymerens sammansättning.
CoPhMoRe fungerar när en specifik polymer adsorberas på nanopartikelytan och skapar en korona som känner igen målmolekylen. Dessa interaktioner är mycket specifika, precis som bindningen mellan en antikropp och dess mål. Bindning av målet förändrar kolnanorörens naturliga fluorescens, låta forskarna mäta hur mycket av målmolekylen som finns.
Stranos labb har tidigare använt denna metod för att hitta igenkänningsplatser och utveckla nansensorer för östradiol och riboflavin, bland andra molekyler. Det nya papperet representerar deras första försök att identifiera koronafaser som kan upptäcka proteiner, som är större, mer komplex, och ömtåligare än de molekyler som identifierats av deras tidigare sensorer.
För denna studie, Bisker började med att screena kolnanorör inslagna i 20 olika polymerer inklusive DNA, RNA, och polyetylenglykol (PEG), en polymer läggs ofta till läkemedel för att öka deras livslängd i blodomloppet.
Själva, ingen av polymererna hade någon affinitet för de 14 testade proteinerna, allt taget från människoblod. Dock, när forskarna testade polymerinpackade nanorör mot samma proteiner, de visade en matchning mellan ett av de modifierade nanorören och fibrinogen.
"En kemist eller en biolog skulle inte kunna förutsäga i förväg att det skulle finnas någon form av affinitet mellan fibrinogen och denna coronafas, "Säger Strano." Det är verkligen en ny typ av molekylärt erkännande. "
Fibrinogen, ett av de vanligaste proteinerna i mänskligt blod, är en del av blodproppskaskaden. När ett blodkärl är skadat, ett enzym som heter trombin omvandlar fibrinogen till fibrin, ett trådigt protein som bildar blodproppar för att täta såret.
En sensor för fibrinogen kan hjälpa läkare att avgöra om patienter som tar blodförtunnande medel fortfarande har tillräckligt med koaguleringsförmåga för att skydda dem från skador, och kunde tillåta läkare att beräkna mer finjusterade doser. Det kan också användas för att testa patienters blodpropp innan de opereras, eller för att övervaka sårläkning, säger Bisker.
Syntetiska antikroppar
Forskarna tror att deras syntetiska molekylära igenkänningsmedel är en förbättring jämfört med befintliga naturliga system baserade på antikroppar eller DNA-sekvenser kända som aptamerer, som är ömtåligare och tenderar att försämras med tiden.
"En av fördelarna med detta är att det är ett helt syntetiskt system som kan ha en mycket längre livstid i kroppen, säger Bisker.
Under 2013, forskare i Stranos labb visade att kolnanorörssensorer kan förbli aktiva i möss i mer än ett år efter att ha bäddats in i en polymergel och kirurgiskt implanterats under huden.
Förutom insulin, forskarna är också intresserade av att detektera troponin, ett protein som frigörs av döende hjärtceller, eller upptäcka proteiner associerade med cancer, vilket skulle vara användbart för att övervaka framgången med kemoterapi. Dessa och andra proteinsensorer kan bli kritiska komponenter i enheter som levererar läkemedel som svar på ett tecken på sjukdom.
"Genom att mäta terapeutiska markörer i människokroppen i realtid, vi kan möjliggöra läkemedelsleveranssystem som är mycket smartare, och släpper ut droger i exakta mängder, "Säger Strano." Men mätning av dessa biomarkörer är det första steget."