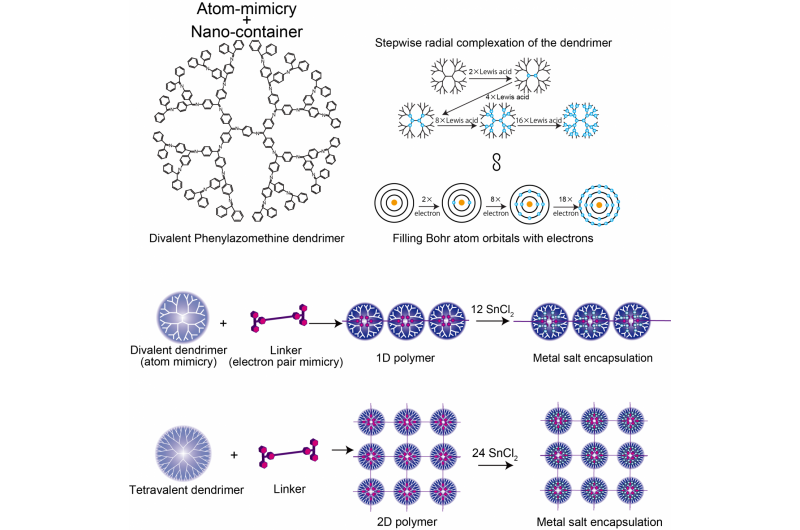
Strukturen för Divalent Phenylazomenthine dendrimer, Jämförelse av DPA- och Bohr -atommodellen, och 1D/2D supramolekylär polymer. Upphovsman:Tokyo Institute of Technology
Inom nanoteknik är kontroll avgörande. Kontroll över arrangemang och avstånd mellan nanopartiklar kan tillåta skräddarsydda interaktionsstyrkor så att egenskaper kan utnyttjas i enheter som plasmoniska sensorer. Nu använder forskare vid Tokyo Institute of Technology dendrimerer som efterliknar atomernas elektronvalens och länkar dem till matriser med hjälp av molekyler som koordinerar med dendrimeren eftersom de skulle bilda ett kovalent elektronpar i deras valensskal - "elektronparmimikri".
Kimihisa Yamamoto, Ken Albrecht, och kollegor på Tokyo Tech övervägde dendritisk polyfenylazometin (DPA), som har en struktur som förgrenar sig från en central kärna. "Lewis -syra" -molekyler koordinerar till "Lewis -bas" -ställena i DPA. Analys av förhållandet mellan SnCl2 Lewis -syramolekyler som koordinerar med varje dendrimer avslöjade stegökningar från 2 till 4 till 8 till 16, som efterliknar valensen för Bohr -atomen som har 2, 8, 18, och 32 elektroner i den första, 2:a, 3:e, och fjärde orbitaler. Detta återspeglar ökningen av antalet molekyler som kan koordinera med dendrimer med ökande avstånd från kärnan, eftersom antalet dendrimergrenar och elektrontäthet ökar.
Yamamotos team analyserade koordineringen av DPA med en starkare bindande Lewis -syra - trifenylmetylium (TPM) - bunden till den stavliknande molekylen fenylenetylen. Fylenetynlen -skelettet är tillräckligt styvt för att syrakatjonerna i vardera änden inte då kan binda till samma dendrimer. Istället bildas en polymerkedja av dendrimerer. Att använda en annan startdendrimer (ZnPG4 istället för DPAG4) - som har en kärnvalens på fyra istället för två - ledde till bildandet av tvådimensionell polymerisation av dendrimererna, producerar en 2D -uppsättning nanokontainrar för att kunna ackumulera andra Lewis -syror i de yttre orbitalerna.
Arbetet beskriver "en ny aspekt av atommimikri" avslutar forskarna. "Geometri och tonhöjd kan styras av utformningen av dendrimer och länkare och är potentiellt tillämpliga på plasmonik (efter frömedierad tillväxt) och nanoelektrodgaller (som också är användbara som elektrokatalysatorer)."
Studien publiceras i Vetenskapliga framsteg .
Bohr atom
Bohr -modellen av atomen som Niels Bohr och Ernest Rutherford redogjorde för 1913 beskriver atomen som en positiv kärna omgiven av elektroner i olika skal eller energinivåer. Varje skal har ett föreskrivet antal elektroner som kan uppta det - det vill säga två elektroner kan uppta det första skalet, åtta nästa, och arton nästa, och så vidare.
Även om det finns aspekter av atombeteendet som modellen inte täcker, det är särskilt framgångsrikt för att förklara spektralemissionsledningarna. När upphetsad, en elektron kan hoppa till nästa energinivå. När den återgår till den ursprungliga energinivån, skillnaden i energierna avges som ljus vid den specifika våglängden som motsvarar energiskillnaden.
Där ett skal inte är fullt, atomen kan binda sig till en annan kemisk art. På detta sätt beskriver en atoms valens hur full elektronskalet är och hur lätt bindningar kan bildas. Elektrondensitetsgradienten för dendrimerer som rör sig radiellt från kärnan till de mer grenade yttre områdena dikterar hur många Lewis -syrakoordinerande molekyler den kan rymma och på detta sätt efterliknar den energinivåerna i Bohr -atomen.
Vad är en Lewis -syra
En Lewis -syra är en kemisk art som kan ta emot ett par elektroner från en kemikalie som kan donera ett ensamt par, det är, från en Lewis -bas. Detta beteende definieras av kemikaliens elektronstruktur. Lewis -syror inkluderar sura föreningar men även metallkatjoner.
När dendrimeren koordinerar med Lewis -syrorna tar den platsen för Lewis -basen som skulle donera ett elektronpar. Forskarna beskriver di-Lewis-syraföreningen (länkmolekyl) som elektronparmimik.
Isosbestiska punkter
När två kemikalier reagerar kan mängden ljus som absorberas förändras beroende på hur mycket ljus produkterna jämfört med reaktanterna absorberar. Om produkterna och reaktanterna absorberar samma mängd ljus vid en viss våglängd, det beskrivs som den isosbestiska punkten.
Forskarna använde isosbestiska punkter för att identifiera stegökningarna i Lewis -syra som reagerar med dendrimererna. En våglängdsförskjutning i den isosbestiska punkten indikerar koordinering av Lewis -syran till det efterföljande skiktet av dendrimer.