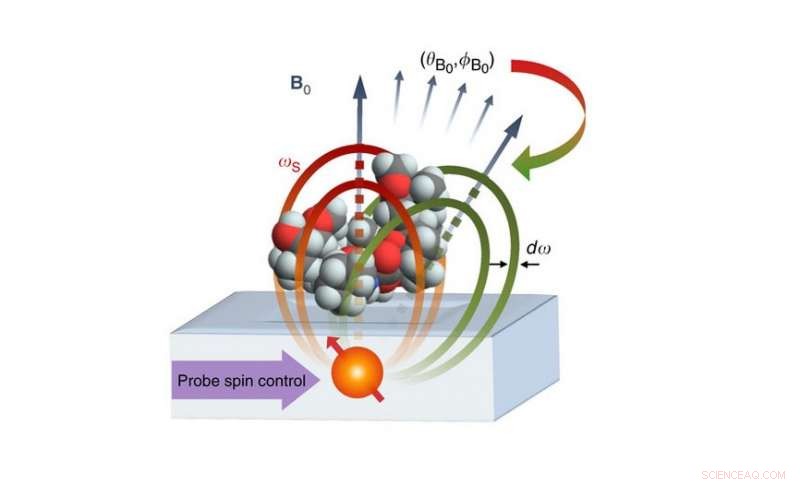
Den föreslagna nano-MRI-installationen består av en atomisk qubit placerad 2-4 nm under en yta som håller en molekyl. Qubit fungerar både som sensor och källa för magnetfältet för kodning av molekylens nukleära snurr. Kärntäthetsdata används sedan för att generera en 3D-bild av molekylstrukturen med upplösning på ångström. Upphovsman:Perunicic et al., Naturkommunikation
(Phys.org) - På samma sätt som en konventionell magnetisk resonansavbildningsmaskin (MRI) använder stora magneter för att generera 3D -bilder, fysiker har utvecklat ett förslag till en kvant-nano-MRI-maskin som skulle använda de magnetiska egenskaperna hos en enda atomkvit för att generera 3D-bilder med upplösning på ångström (0,1-nanometer). Den nya tekniken kan leda till utvecklingen av enmolekylära mikroskop för avbildning av biomolekyler, med tillämpningar inom upptäckt av läkemedel och bättre förståelse av sjukdomar.
Forskarna, ledd av Lloyd Hollenberg, fysikprofessor vid University of Melbourne, har publicerat ett papper om den nya tekniken i ett senaste nummer av Naturkommunikation .
"Kontinuerliga vetenskapliga framsteg under de senaste decennierna har gjort det möjligt för oss att förstå och därför bota många medicinska problem i makroskopisk skala, till exempel benfrakturer eller blodproppar, "berättade huvudförfattaren Viktor Perunicic vid University of Melbourne Phys.org . "Dock, sjukdomarna som mänskligheten står inför idag är mikroskopiska, eftersom de härrör från störningar på molekylär nivå, till exempel ett protein med en deformerad form någonstans i en cell. Cancer, diabetes, virusinfektioner och många andra har detta gemensamt, men för närvarande finns det nästan inget sätt att se vad som händer inuti våra kroppar på denna nivå.
"I vårt arbete, vi strävar efter att ta itu med detta problem genom att utveckla en plan för teknik som kan möjliggöra direkt visuell 3D -inblick i atomstrukturen hos enskilda molekyler i deras cellulära miljö. Vi uppnår detta genom att utnyttja kvantberäkningsteknik i ett koncept som ger magnetisk resonansavbildning till atomskala. "
Det föreslagna avbildningssystemet består av en atomkvbit som är placerad cirka 2 nanometer under en yta som håller molekylen som ska avbildas. Qubit fungerar både som källa och sensor för magnetfält, med sina kvantmagnetiska egenskaper (dess snurr) i samverkan med de magnetiska egenskaperna hos atomerna i målmolekylen. Genom att samla in data om dessa interaktioner i olika riktningar, systemet kan bestämma positionerna för enskilda atomer och konstruera en 3D -bild av målmolekylens struktur.
Forskarna simulerade den nya tekniken med hjälp av en rapamycinmolekyl (C 51 H 79 NEJ 13 ), ett immunsuppressivt läkemedel som vanligtvis används för att förhindra avstötning av organtransplantationer. I konventionella bildtekniker, såsom röntgenkristallografi, det är svårt att upptäcka väteatomerna. Men genom att mäta vätgas nukleär spinndensitet, nano-MRI-metoden kan generera 3D-bilder av väteatomerna, liksom kolatomerna, med en genomsnittlig bildupplösning på ångströmnivån.
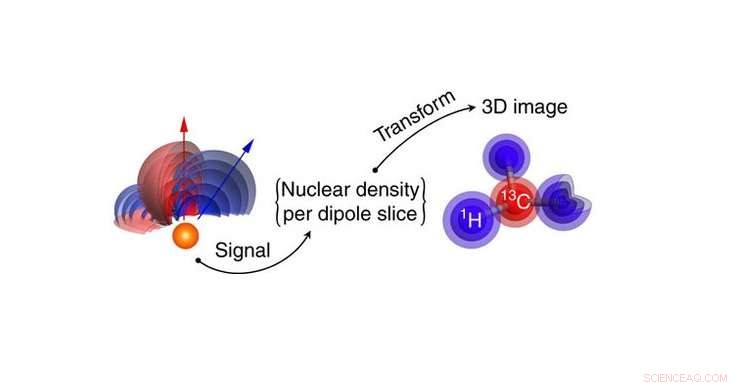
Målmolekylens kärntäthet omvandlas till en 3D -kärntäthetsbild av väte och kolatomer. Atomlägen extraheras direkt från densitetsbilddata. Upphovsman:Perunicic et al., Naturkommunikation
"Förmågan att avbilda molekylernas atomära struktur i deras inhemska cellulära miljöer är avgörande för att både förstå sjukdomens ursprung och hitta dess botemedel, "Sa Hollenberg." Till exempel vid sökning och testning av nya läkemedel skulle man först identifiera ett mål, ofta ett membranprotein. Avbildning av proteinets sanna struktur i cellmiljön är nyckeln till att förstå hur läkemedelsmolekyler kommer att interagera med det. På grundval av denna information, en läkemedelsmolekyl kan väljas eller utformas. Viktigt, samma bildanordning skulle ge medel för att förstå och testa hur väl läkemedlet fungerar, genom att observera dess interaktioner med målmolekylen på atomnivå. Vårt mål är att utveckla en mångsidig teknik för att observera den för närvarande otillgängliga biokemiska atomstrukturen för viktiga molekyler in situ, på ett analogt sätt till hur sjukhus -MR -maskiner observerar kroppens anatomi. "
På grund av den stora mängden data som berörs, simuleringar visar att den totala tiden för att generera en bild av rapamycinmolekylen för närvarande är cirka 175 timmar. Dock, forskarna förväntar sig att framtida förbättringar kommer att minska denna tid kraftigt, samt öka upplösningen ytterligare. I framtiden, de planerar också att skala upp systemdesignen för avbildning av större biomolekyler.
"Hittills har vårt arbete fokuserat på den grundläggande teoretiska grunden, förstå hur man fysiskt konstruerar enheten med för närvarande tillgänglig teknik, "Perunicic sa." Vi utvecklar den invecklade kvantmekaniska kontrollen som skulle ge kapacitet att avbilda enskilda molekyler, och utför också simuleringar för att testa prestandan under realistiska förhållanden. Eftersom resultaten av dessa undersökningar var uppmuntrande, den naturliga inriktningen för de kommande åren är att ge sig ut på experimentella demonstrations-proof-of-concept-demonstrationer. "
© 2016 Phys.org