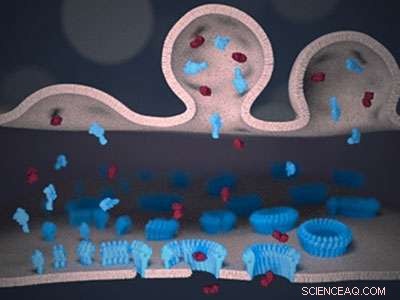
Schematisk bild av immunsynapsen mellan en lymfocyt (överst) och en målcell (nederst). Perforin (blått) och granzym (rött) levereras till synapsen från lymfocytmembranet (överst). Perforin binder till målmembranet (botten) och, efter en "växande por"-mekanism, bildar transmembranporer. Porerna tillåter giftiga granzymer att passera målmembranet, och utlösa celldöd. Kredit:Adrian Hodel, UCL
Hur den naturliga försvarskraften i vårt immunsystem attackerar och förstör skadliga inkräktare som virusinfekterade och cancerceller har visualiserats i mikroskopisk detalj av forskare från UCL, Birkbeck, University of London, Peter MacCallum Cancer Center och Monash University, Australien.
Forskningen, publiceras idag i Naturens nanoteknik , fördjupar förståelsen för den kritiska rollen av proteinet som kallas 'perforin' i ett fungerande immunsystem, tar oss ett steg närmare nya terapier med potential att öka eller hämma dess effekt när det behövs.
Professor Bart Hoogenboom (UCL Physics &Astronomy och London Centre for Nanotechnology) och professor Helen Saibil (Birkbeck, University of London) använde atomkraftsmikroskopi och elektronmikroskopi för att avslöja exakt hur en undergrupp av vita blodkroppar, kallas cytotoxiska lymfocyter (eller Killer T-celler), visa anmärkningsvärd effektivitet i att först perforera sina offer och sedan injicera giftiga enzymer för att befria kroppen från sjukdomar.
Med hjälp av en form av mikroskopisk CCTV, det visades hur perforin binder till det skyddande membranet som omger skadliga celler. Professor Hoogenboom sa:"Vårt immunsystem måste borra hål i virusinfekterade och cancerceller för att bli av med dem, men kan inte köpa sådana borrar i en byggbutik. Vi har nu visat hur den självmonterar dessa borrar på plats genom att sätta ihop flera perforinmolekyler i ringliknande strukturer, lämnar små hål - bara tiotals nanometer i diameter."
Docent Ilia Voskoboinik, en ledande medförfattare (Peter MacCallum Cancer Center), sa:"Att döda virusinfekterade eller cancerceller, perforin måste vara snabb och effektiv. Våra experiment i Melbourne visar att patienter som är födda med nedsatt perforin kan leda till dödligt immunförsvar och också ha en högre risk att utveckla blodcancer.
"Detta överensstämde helt med de mikroskopiska data som erhölls i London, vilket visar att effektiviteten av perforin är kraftigt hämmad även om endast ett litet antal av perforinmolekylerna är onormala. Denna nya förståelse för oss ett steg närmare riktade terapier som kan stärka kroppens perforinproducerande kraft för att avvärja sjukdom. Vi kan också hämma dess funktion för att förhindra avstötning av organtransplantationer, när man tar emot främmande vävnader eller celler kan det istället vara livräddande."
För att filma in action, forskarna använde atomkraftsmikroskopi i professor Hoogenbooms labb vid London Centre for Nanotechnology vid UCL. Denna typ av mikroskopi använder en ultrafin nål för att känna i stället för att se perforin på ett målmembran, liknar en blind person som läser punktskrift. Nålen skannar upprepade gånger ytan för att producera en bild som uppdateras tillräckligt snabbt för att spåra hur perforinmolekyler går ihop och skär hål i membranet.
Initialt, perforin dök upp som en oskärpa på dessa bilder. Dock, en gång ett par perforinmolekyler tillsammans infördes i membranet, de skulle kunna identifieras tydligare och visa sig rekrytera mer perforin för att på så sätt växande transmembranporer.
Genom att även spela in statiska ögonblicksbilder med högre upplösning med hjälp av elektronmikroskopi, Professor Saibils team lyckades uppskatta, för varje perforin montering, antalet molekyler i varje steg av processen. Detta bekräftade en förändring från löst packade små perforinenheter på membranet till större och mer tätt bundna transmembranporer.