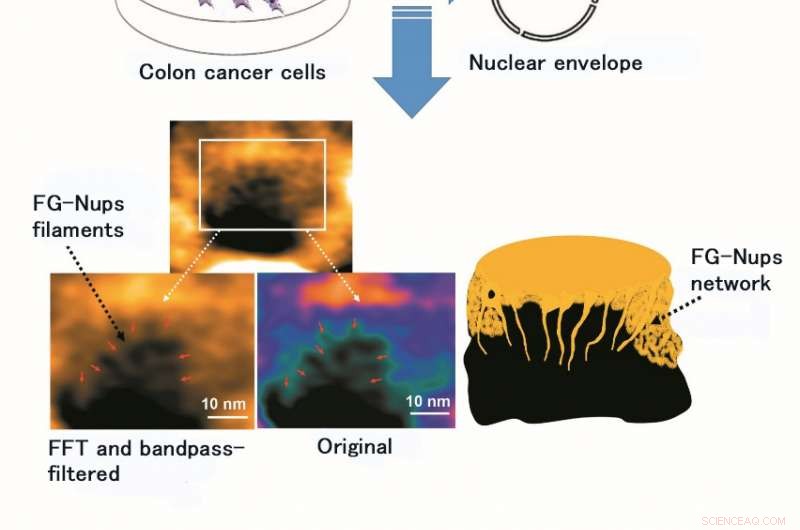
Användning av HS-AFM möjliggjorde observation och videoavbildning av struktur och dynamik hos FG-Nups filament, ett proteinkomplex av mjukt och flexibelt foder. Figuren visar den ursprungliga bilden av FG-Nups-tråden och den efter bearbetning med Fast Fourier Transform (FFT) och ett bandpassfilter (ett bandpassfilter tillåter endast genomträngning av ljus med viss våglängd). Kredit:Kanazawa University
En av de viktigaste orsakerna till cancerdödlighet är cancercellernas mycket invasiva beteende, vilket ofta beror på aggressiv metastasering. Metastasering underlättas av olika tillväxtfaktorer och cytokiner som utsöndras från celler i immunsystemet, som fungerar genom olika signalvägar. Anmärkningsvärt, dessa signalvägar kommer in i kärnan genom kärnporkomplexet (NPC), som är tänkt att fungera som dörrvakt till kärnan. NPC är, faktiskt, en nanomaskin som består av flera kopior av cirka 30 olika proteiner, gemensamt kallad nukleoporin.
Även om små molekyler kan gå igenom kärnporerna ganska fritt, molekyler större än 40 kDa skulle kunna göra det effektivt endast genom att binda till specifika transportproteiner som interagerar med FG-Nups (nukleoporiner har repeterande enheter av två aminosyror fenylalanin (F) och glycin (G), vilka är tentakelproteiner som har specifika och väljande roller i portransport. Även om olika modeller föreslås, hur FG-Nups deltar i kärnan-cytoplasma-transporten är i stort sett okänt. Ändå, den samtidiga bedömningen av nanoskopiska strukturer och dynamik har varit tekniskt omöjlig, en situation som råder genom hela cellbiologiska forskningen. Den direkta visualiseringen av NPC -dynamik vid nanoskalaupplösning ansågs vara omöjlig.
Forskargruppen vid Kanazawa-universitetet undersökte denna viktiga fråga och fick de banbrytande resultaten genom kombinerad högupplöst levande cellavbildning, elektronmikroskopi, och höghastighets-AFM (HS-AFM) som utvecklats av dem själva för att undersöka den inhemska nanoskopiska rumsliga och tidsmässiga dynamiken i NPC-strukturer i tjocktarmscancercellerna.
Först, de genererade NPC-stabila cellinjer som uttryckte GFP (grönt fluorescerande protein) och bekräftades med fluorescerande mikroskopi. Nästa, de isolerade det mycket renade kärnhöljet som bekräftades genom användning av negativ fläckelektronmikroskopi och konfokalmikroskopi. Sedan, de startade observationen av spatiotemporala förändringar i millisekunder och nanometerskala av NPC-struktur i ursprungligt tillstånd i tjocktarmscancerceller genom att kombinera högupplöst levande cellavbildning och elektronmikroskopi. I synnerhet, de utförde observationen av levande kärnhölje och kärnporer med hjälp av HS-AFM.
Forskargruppen vid Kanazawa University var, verkligen, framgångsrik i att avbilda dynamiken hos NPC-proteiner i cancerceller, som är byggstenarna i kärnporen (Figur 1). MLN8237/alisertib, en apoptotisk och autofagisk inducerare, genomgår för närvarande flera kliniska cancerprövningar. Detta läkemedel rapporterades hämma nukleoporinuttryck och aktiviteter. Forskarna visualiserade inhemska och läkemedelsbehandlade FG-Nups av HS-AFM. Särskilt, de förlängda och tillbakadragna FG-Nups med ett spindelnätsutseende förlorades i läkemedelsbehandlade prover (Figur 2). Forskargruppen drog slutsatsen att via HS-AFM, de visualiserade deformationen och förlusten av FG-Nups kärnporbarriär, som kan vara den första nanodödande koden som upptäcktes i världen.
Den nuvarande studien av forskargruppen vid Kanazawa University möjliggjorde visualisering av strukturen och dynamiken i kärnmembranets porer i nanometer skala, och det visas att deformation och förlust av kärnmembranets porbarriär skulle vara en av de döande koder för cancerceller. Dessa fynd står för ett nytt paradigm i vår förståelse av kärnkraftstransporter, som har, fram till denna punkt, förblev ett gåtfullt problem inom nanomedicin och cellbiologi. Aktuella rön är baserade på bioavbildningsteknologin som utvecklats vid Kanazawa University. Denna studie har medicinska tillämpningar inklusive att fungera som en ny "nano-endoskopi" för att visualisera intracellulära organeller såsom kärnan och kärnporer, och molekylär dynamik i cancerceller och andra sjukdomar.
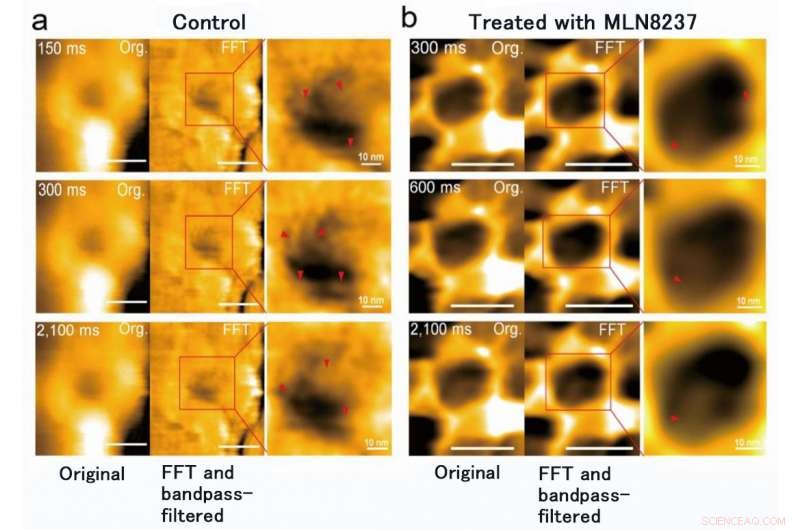
MLN8237-behandling av cancerceller orsakade deformation och förlust av FG-Nups-barriär. Man fann också att kärnporens innerdiameter ändrades från 86 ± 13 nm till 53 ± 9 nm och djupet, från 4 ± 2 nm till 7 ± 1 nm. Kredit:Kanazawa University