Fig. 1 Effekt av integrationsmetod. Kredit:Hisasi Tadakuma / Osaka University
Genuttryck är en grundläggande för livet, där varje cell slår på och av specifika gener. Således, en autonom enhet som kunde styra på/av-omkopplingen skulle ha stort värde inom sjukvården.
Syntetiska genetiska kretsar är en teknik för att kontrollera genuttryck och programmera celler för att utföra önskade funktioner. Därför, Genom att öka komplexiteten i den genetiska kretsen kommer vi att kunna kontrollera cellöden mer exakt.
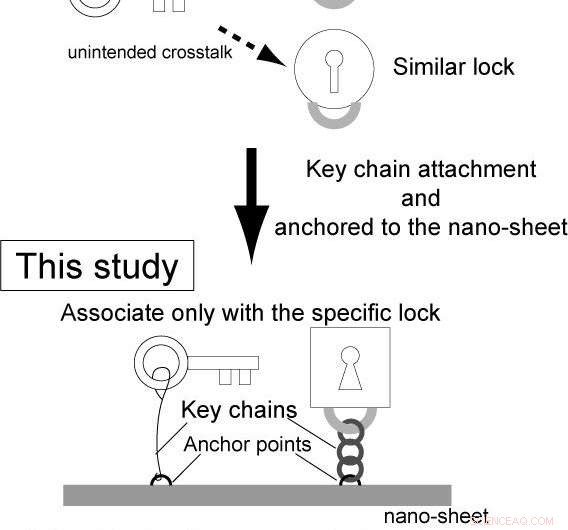
Dock, komplexiteten hos genetiska kretsar är fortfarande låg. Det här är för att, i konventionella reaktionsdiffusionssystem, enzymerna och substraten tillhandahålls separat, och ospecifik bindning av enzymerna till substraten orsakar oavsiktlig överhörning mellan de olika kretsarna.
Osaka University-ledda forskare, i ett gemensamt forskningsprojekt med University of Tokyo, Kyoto universitet, och Waseda University, konstruerade integrerade genlogik-chips som kallas "gen-nanochips." Med hjälp av integrerade faktorer på nanochipsen, dessa fristående nanochips kan slå på och av gener inom ett enda chip, förhindra oavsiktlig överhörning.
Forskarna visade de autonoma svaren från nanochipsen i konstgjorda celler:miljöavkänning, informationsberäkning och produktutdata på enkelchipsnivå. Deras forskningsresultat publicerades i Naturens nanoteknik .
DNA-nanoteknik är en mångsidig metod som används för att konstruera anpassade strukturer och för att kontrollera exakta molekylära layouter. Forskarna använde ett rektangulärt ark (90 nm brett, 60 nm djup, 2 nm hög), och integrerat enzym, RNA-polymeras (RNAP, ett enzym som syntetiserar RNA från en DNA-mall), och multipla målgensubstrat.
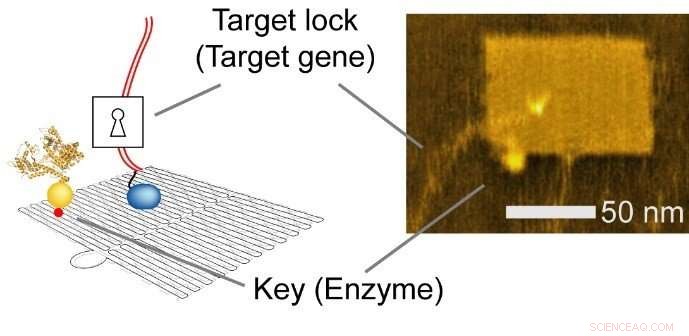
Fig. 2 Integrerat nanochip. Vänster, Schematisk illustration. Höger, atomic force microscopy (AFM) bild. Kredit:Hisashi Tadakuma / Osaka University
Nano-layout-förmågan hos DNA-nanoteknik gör det möjligt för forskaren att rationellt utforma genuttrycksnivåer genom att ändra de intermolekylära avstånden mellan enzymet och målgenerna, vilket påverkar kollisionseffektiviteten och efterföljande reaktion.
Forskarna integrerade ytterligare sensorer. Helst en sensor som kan detektera vilken typ av signal som helst bör ha minimala designbegränsningar. Dock, konventionella metoder har lidit av flera begränsningar (t.ex. material). Det här är för att, i konventionella genetiska kretsar, sensorn är en del av enzymets substrat (t.ex. DNA i transkription; se anmärkning för detaljer).
Omvänt, i den här studien, sensordelen var oberoende av den enzymatiska reaktionen. Således, forskarna kan använda vilket sensormaterial som helst som ändrar det effektiva intermolekylära avståndet vid signaligenkänning, möjliggör konstruktion av olika sensorer som svarar på distinkta signaler (mikroRNA, kemiska föreningar, proteiner och ljus). Dessutom, genom att kombinera och integrera sensorer som svarar på distinkta signaler, forskarna har lyckats med foto-omprogrammering av de genetiska kretsarna.
Till sist, nanochippet gjorde det möjligt för forskarna att förenkla konstruktionen av en genetisk krets som svarade på en konstgjord cell, en vatten-i-olja droppe, och de kunde beräkna dess miRNA-profil, genom att helt enkelt blanda de ortogonala chipsen, utökar kraften i den genetiska kretsen.
Motsvarande författare Hisashi Tadakuma säger, "Alla faktorer som är nödvändiga för transkriptionsreaktioner finns på detta integrerade nanochip, så miljökänsla, informationsberäkning, och produktutdata kan slutföras på enkelchipsnivå. Inom en snar framtid, autonoma nanochips kommer att vara användbara för att bibehålla cellen i friskt tillstånd genom att kontrollera genuttryck rumsligt och temporärt, som kommer att förkroppsliga idealet med talesättet "förebyggande är bästa botemedel". "
Helst en sensor som kan detektera vilken typ av signal som helst bör ha minimala designbegränsningar. Dock, konventionella metoder har lidit av flera begränsningar (t.ex. material). Det här är för att, i konventionella genetiska kretsar, effektiviteten av bindning mellan ett enzym som RNAP (nyckel) och en målgen (mållås), specifikt en promotorsekvens på DNA-molekylen, styrs av transkriptionsfaktorer (regulatorer). Eftersom regulatorer och enzymer bör binda till sensorn (operatörsområdet) nära mållåset, materialet i sensorn måste vara ett substrat för regulatorerna och enzymerna (t.ex. DNA i transkription), och regulatorn bör vara ett DNA-bindande protein. Således, både regulatorn (signalen) och sensorn har materialbegränsningar.
Dock, i den här studien, bindningsfrekvensen och efterföljande reaktion styrs av (1) det intermolekylära avståndet mellan ett enzym och en målgen, och (2) egenskaperna hos nyckelringen (t.ex. stelhet, längd). Således är sensordelen oberoende av den enzymatiska reaktionen, och sensorn och regulatorerna har inga materialbegränsningar, låter de olika sensorerna reagera på distinkta signaler (kemiska föreningar, proteiner och ljus).