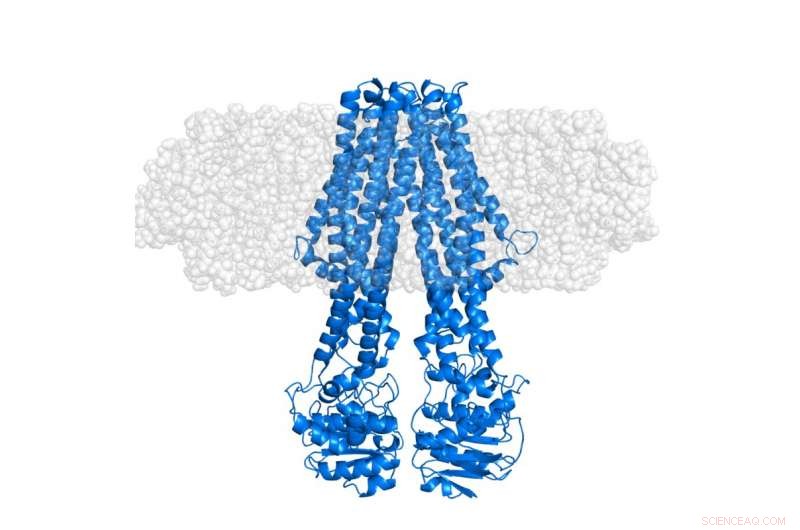
Det integrerade membranproteinet MsbA (blått) inbäddat i en "semi-transparent" membranös nanodskiva (grå). Själva nanoskivan är, genom selektiv deuteration, gjorts osynligt i SANS-experiment som fokuserar på konformationen av proteinet i dess ursprungliga sammanhang. Kredit:Institut Laue-Langevin
Membranen som omger våra celler innehåller ett stort antal proteiner. Membranproteiner är därför en avgörande klass av makromolekyler i levande system. De spelar nyckelroller, som att tillhandahålla transportportar in och ut ur cellen, underlättar signalering mellan celler, samt att vara involverad i enzymkatalys. Dessa funktionella roller gör dem särskilt viktiga som läkemedelsmål, med majoriteten av nuvarande terapeutika inriktade på membranproteiner.
Dock, strukturella studier av integrala membranproteiner (IMP) har visat sig vara extremt utmanande, eftersom de flesta av dem är svåra att studera ordentligt i frånvaro av deras lipidmiljö. Detta förhindrar ofta att de kristalliseras – en metod som vanligtvis används inom klassisk strukturbiologi. Alternativa tillvägagångssätt krävs därför för strukturella studier av IMP i membranösa miljöer. För det här syftet, livsvetenskapsgruppen vid Institut Laue-Langevin (ILL), i samarbete med Köpenhamns universitet, har framgångsrikt banat väg för utvecklingen av stealth carrier nanodiscs. I detta tillvägagångssätt, en sofistikerad deuteriummärkningsmetod används för att göra membranet effektivt osynligt för neutrondiffraktion med låg upplösning samtidigt som strukturen hos IMPs framhävs i deras vanliga lipidmiljö, som publicerades i Acta Crystallographica D 2014.
På senare tid, den första strukturella studien av ett integrerat membranprotein med denna stealth carrier nanodisc-deutereringsstrategi har just avslutats. Detta utfördes med hjälp av Deuteration Laboratory (D-Lab) plattformen för Partnership for Structural Biology (PSB) i kombination med småvinklar neutronspridning (SANS) och röntgenspridning (SAXS) tillhandahållna genom PSB SANS/SAXS-plattformen . Som publicerat i tidskriften Strukturera av Josts et al, det internationella laget, ledd av Henning Tidow, Universitetet i Hamburg, tillämpade denna metod på ett ATP-bindande kassett (ABC) transportprotein, MsbA – som spelar en viktig roll för lipidtransport i bakterier. De resulterande neutronspridningsdata, mestadels förvärvad med D11-instrumentet vid ILL, tillät direkt observation av signalen från det solubiliserade membranproteinet utan bidrag från den omgivande lipiden. SAXS-data gav en tydlig referens för den yttre formen av nanodiskivan, inklusive lipiddubbelskiktet.
Dessutom, konformationsförändringar i MsbA studerades, demonstrera metodens känslighet och dess allmänna tillämpbarhet på strukturella studier av IMP.
Detta tillvägagångssätt kommer sannolikt att bli allt viktigare i framtida studier av dessa svåra, men kritiskt viktigt, biologiska makromolekyler, i sin tur stödja en bättre förståelse för utvecklingen av läkemedel riktade mot membranproteiner.