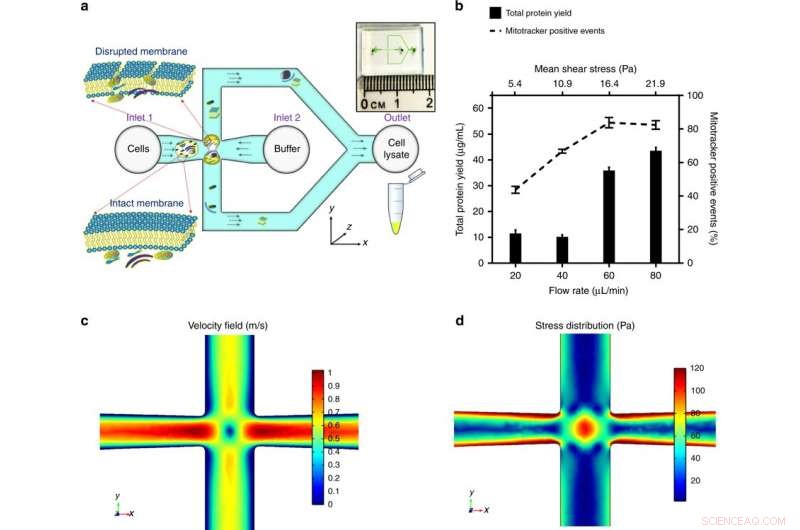
a) Celler införs i korsningen av mikrokanalen. Stressen som appliceras på cellen är optimerad för att störa cellmembranet och frigöra subcellulära komponenter, samtidigt som mitokondriernas integritet bibehålls. Översikten över mikrofluidikkretsen visas i infällningen. b) Den applicerade medelspänningen, moduleras genom att kontrollera den volymetriska flödeshastigheten för en given kanalgeometri, har optimerats av det maximala proteinutbytet (en indikation på kvantiteten av det extraherade subcellulära innehållet) och de maximala mitotracker-positiva händelserna (ett kännetecken för funktionella mitokondrier). Resultat erhölls genom att strimla HEK293-celler (embryonala njurceller, 106 celler/mL) genom ett område av skjuvspänning och plottas som medelvärde ± SD (n = 3 oberoende experiment). En simuleringsmodell med finita element etablerades av COMSOL Multiphysics® för att illustrera fluidflödet vid korsningen. Ge ett volymetriskt flöde vid 60 μl/min, c) illustrerar hastighetsprofilen och stagnationspunkten i mitten (där flödeshastigheten är noll), och d) illustrerar spänningsfördelningen och de extensionella flödesfälten runt stagnationspunkten, vilket avsevärt bidrar till celldeformation och störning. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Mitokondrier är dynamiska, bioenergetiska intracellulära organeller, ansvarig för energiproduktion via ATP-produktion vid andning. De är involverade i viktiga cellulära metaboliska uppgifter som reglerar vitala fysiologiska svar från celler, inklusive cellsignalering, celldifferentiering och celldöd. Defekta mitokondrier är kopplade till flera kritiska mänskliga genetiska sjukdomar, inklusive neurodegenerativa störningar, cancer och hjärt- och kärlsjukdomar.
Den detaljerade karakteriseringen av funktionella mitokondrier är fortfarande relativt outforskad på grund av bristen på effektiva organellextraktionsmetoder. Till exempel, extraktionsprocessen måste upprätthålla tillräcklig funktionalitet hos organellen ex vivo för att belysa deras cytosoliska funktioner i närvaro av cytoskelett och andra subcellulära organeller. Eftersom mitokondrier växer i ett komplext retikulärt nätverk i celler för att genomgå strukturella växlingar, deras intracellulära karakterisering är ytterligare komplicerad. Som ett resultat, in vitro analys av mitokondrier förblir den vanliga metoden, att separat extrahera och förstå de inneboende egenskaperna hos mitokondrier, utan inblandning av andra subcellulära organeller.
I en nyligen genomförd studie, nu publicerad i Mikrosystem och nanoteknik , Habibur Rahman och kollegor vid institutionen för biomedicinsk teknik undersökte möjligheten att kontrollera hydrodynamisk stress för effektiv mitokondriell extraktion. För detta, de använde korsövergångsmikrofluidisk geometri i mikroskala för att selektivt störa cellmembranet samtidigt som det säkrade mitokondriella membranets integritet.
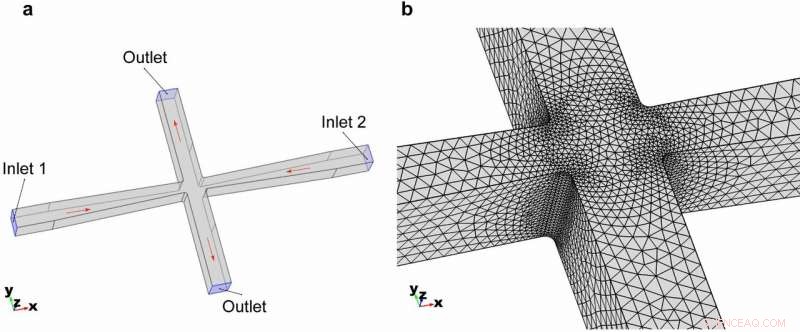
3D-geometri av cross-slot-mikrofluidikkanalen. (a) Övergripande geometri och modellens randvillkor. (b) Sammankoppling av elementen som zoomat i korsslitsområdet. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y
Framsteg inom mikrofluidik har visat fördelarna med laboratorieprocedurer på chip med avsevärt minskad provstorlek och ökad experimentell reproducerbarhet. Hydrodynamisk stress producerad i mikrofluidiska chips kan användas för att öppna cellulära eller nukleära membran övergående under intracellulär genleverans. Potentialen för sådana tekniker har sällan undersökts för att extrahera subcellulära organeller eftersom de begränsade geometrierna hos mikrokanaler kan orsaka igensättning av subcellulära komponenter i mikromaskinerna.
Författarna optimerade de experimentella driftsförhållandena baserat på tidigare studier för att effektivt riva cellmembran samtidigt som de bibehöll intakta mitokondrier i modelldäggdjurscellinjer. Modellcellinjerna av intresse var mänskliga embryonala njurceller (HEK293), musmuskelceller (C2C12) och neuroblastomceller (SH-SY5Y).
I arbetsprincipen för den föreslagna cellförstöraren i mikroskala, forskarna mätte skillnaden i elasticitetsmodul mellan mitokondriella membran och cellmembran för att störa cellen samtidigt som mitokondriella membran bibehölls. En ökad stressnivå i systemet kan störa cellmembran med högre elasticitetsmoduler (som ses med neuroblastomcellinjen). Studien jämförde proteinutbytet och koncentrationen av extraherade funktionella mitokondrier med den föreslagna metoden kontra kommersiellt tillgängliga kit för en rad cellkoncentrationer.
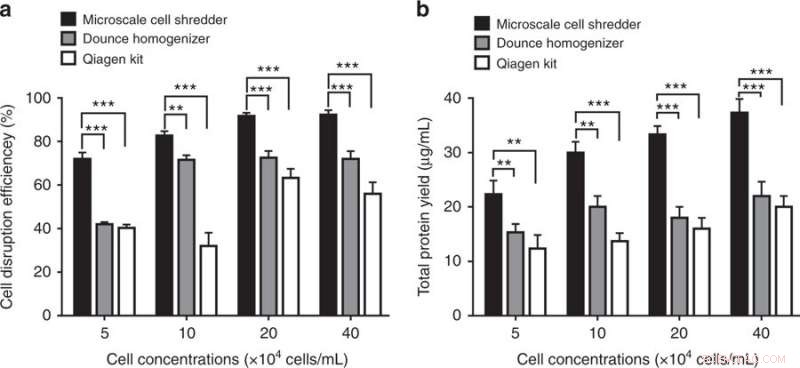
Cellavbrott och proteinextraktionseffektivitet med hjälp av cellförstörare i mikroskala, Dounce Homogenizer och Qiagen Mitochondria Isolation Kit. a) Cellavbrottseffektivitet, bestäms av andelen avbrutna celler mot det totala antalet intakta celler, kvantifierades vid olika cellkoncentrationer. b) Efter centrifugeringsstegen, totalt proteinutbyte bestämdes i enlighet därmed. Dessa experiment utfördes med användning av HEK293-celler. Resultaten plottades som medel ± SD (n = 3 oberoende experiment, **P < 0,01, ***P < 0,001). Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Resultaten visade att den föreslagna cellförstörarmetoden i mikroskala var effektivare än de kommersiella kiten genom att ge cirka 40 procent mer funktionella mitokondrier. Forskarna kunde bevara den strukturella integriteten hos de extraherade organellerna även vid låga cellkoncentrationer. Metoden kunde snabbt behandla en begränsad mängd prover (200 µl).
De detaljerade resultaten var en första i studien demonstration av intakt och funktionell mitokondrierextraktion med hjälp av hydrodynamisk stress i mikroskala. Möjligheten att bearbeta en låg koncentration och liten provstorlek är gynnsam för kliniska undersökningar av mitokondriell sjukdom. För att testa spänningen som utövas av den designade korsningen, de använde först en COMSOL Multiphysics-simuleringsmodell. Därefter, Rahman et al. experimentellt bestämde den volymetriska flödeshastigheten för tre modellcellinjer. Under experimentell cellmembranstörning, under medelskjuvspänning (16,4 Pa, för en flödeshastighet på 60 µL/min), subcellulära organeller frigjordes och detekterades med ökade mitokondriella positiva signaler.
Forskarna jämförde kapaciteten hos den miniatyriserade cellförstöraren med kapaciteten hos två kommersiella kit:Dounce-homogenisatorn (mekanisk metod för cellstörning) och Qproteome-mitokondrierisoleringskit (kemisk metod för cellstörning) för att extrahera mitokondrier. För att bestämma antalet funktionella mitokondrier som extraheras, forskarna använde MitoTracker – ett fluorescerande färgämne som färgar mitokondrier under flödescytometrisk analys. Resultaten visade att cellförstöraren i mikroskala kunde extrahera 40 procent mer funktionella mitokondrier jämfört med de kommersiella kiten för både HEK 293- och C2C12-celler.
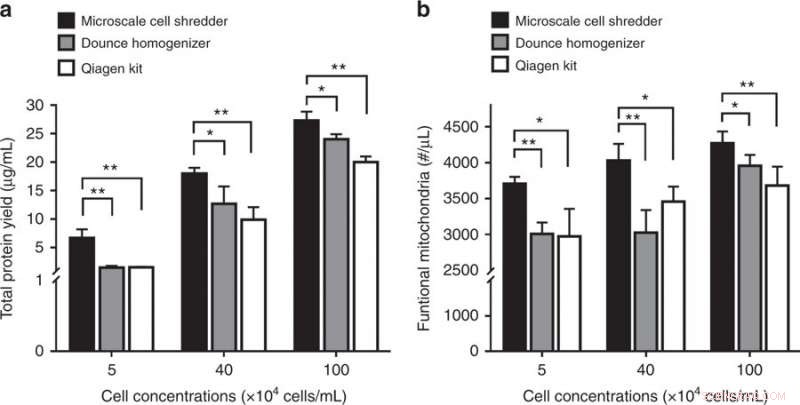
Störning av neuroblastomceller (SH-SY5Y) och efterföljande mitokondriell extraktion. a Totalt proteinutbyte och b-koncentrationer av funktionella mitokondrier erhållna från de tre extraktionsmetoderna. Resultaten plottades som medel ± SD (n = 3 oberoende experiment, *P < 0,05, **P < 0,01). Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y.
Rahman et al. genomförde citratsyntasanalysen för att bestämma mitokondriell integritet genom enzymatisk aktivitet av skadade mitokondrier. Som förut, jämfört med de kommersiella kiten, mitokondriell integritet var högre för de som extraherades med användning av mikroskalaförstörare i HEK293- och C2C12-celler.
Studien visade vikten av membranstyvhet genom att validera det föreslagna konceptet för att störa neuroblastomcellmembran (SH-SY5Y). Eftersom SH-SY5Y-cellmembranet hade en högre elasticitetsmodul än både HEK293- och C2C12-cellinjer, forskarna var tvungna att optimera den volymetriska flödeshastigheten i dokumentförstöraren i mikroskala för att effektivt kunna störa SH-SY5Y-cellmembran. På nytt, jämfört med de kommersiella kitextraktionerna, med hjälp av den föreslagna metoden levererade en signifikant högre koncentration av protein och funktionella mitokondrier för cellinjen av intresse.

En halssektion ingår i kanalutformningen av cellförstöraren i mikroskala för att säkerställa att cellerna fokuseras lateralt mot mitten av flödesströmmen i mikrofluidikbioreaktorn. Kredit:Microsystems &Nanoengineering, doi:https://doi.org/10.1038/s41378-018-0037-y
På det här sättet, Rahman et al. undersökte möjligheten att störa cellmembranet för att bibehålla integriteten hos mitokondriella membran i olika däggdjursmodellcellinjer. De bestämde den optimala förlängningsspänningen och flödeshastigheten inuti en bioreaktor med mikrofluid tvärsnitt, baserat på Youngs modul för modellcellinjen av intresse. Under kanaldesign, forskarna inkluderade en halssektion i den mikrofluidiska bioreaktorn tillverkad med mjuk litografi.
Den föreslagna mikrofluidiska cellförstöraren i mikroskala visade överlägsen förmåga att extrahera funktionella mitokondrier och proteiner genom att kontrollera hydrodynamisk stress för första gången, jämfört med kommersiellt tillgängliga cellorganellextraktionssatser. Experimenten var genomförbara även med små mängder prover (200 µl volym, innehållande 10 4 celler/ml) för potentiella kliniska tillämpningar. Rahman et al. kunde troget replikera protokollet över tre cellinjer. Det experimentella arbetet kan översättas till en klinisk miljö för att förstå mitokondriell dysfunktionsrelaterade störningar på djupet.
© 2019 Science X Network