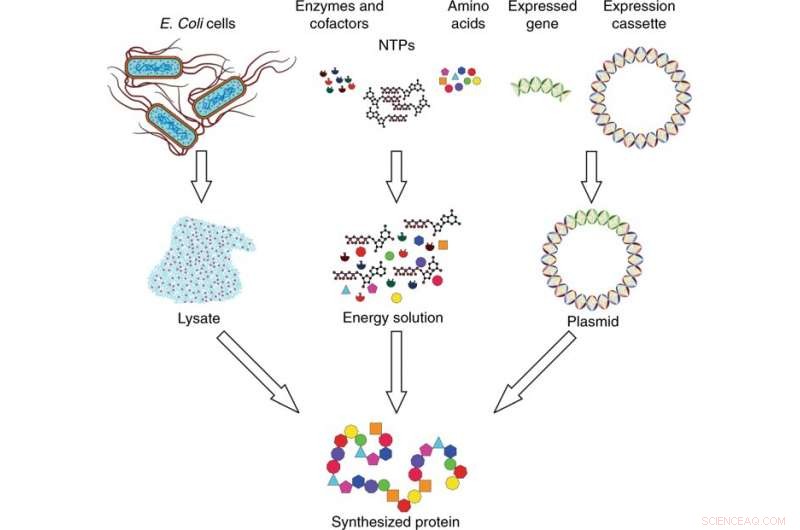
Översikt över cellfritt proteinsyntessystem. Syntessystemet består av tre komponenter:lysat, energilösning, och plasmid -DNA. Lysatet uppsamlas från E. coli -celler genom celllys och bereds med användning av ultracentrifugering. Energilösningen består av nukleosidtrifosfater (NTP), aminosyror, enzymer, och kofaktorer. Plasmid -DNA framställs genom att sätta in den uttryckta genen av intresse i en expressionskassett. De tre komponenterna kombineras och inkuberas för att syntetisera protein av intresse. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
Terapeutiska proteiner är proteinbaserade läkemedelskandidater som är biotekniska i laboratoriet för farmaceutiska och kliniska tillämpningar. Baserat på deras farmakokinetik, kandidaterna kan delas in i grupper som (1) ersätter ett defekt eller onormalt protein, (2) förstärka en befintlig väg in vivo, (3) tillhandahålla en ny funktion eller aktivitet in vivo, (4) störa en molekyl eller organisms aktiviteter och (5) leverera inkapslade proteiner eller föreningar inklusive, cytotoxiska läkemedel, radionuklid- eller effektorproteiner.
I en ny studie publicerad i Mikrosystem och nanoteknik , Travis W. Murphy och medarbetare vid avdelningarna för kemisk och biologisk systemteknik vid Virginia Tech utvecklade en kostnadseffektiv, vårdande syntetisk och reningsplattform för proteinteknik. De byggde en integrerad mikrofluidik "Therapeutics-on-a-Chip (TOC)" enhet för cellfri, terapeutisk proteinsyntes och terapeutisk proteinrening i en enda installation.
Möjligheten att syntetisera terapeutiska proteiner i en vårdande miljö, kan snabbt minska kostnaderna för lagring och transport under global distribution i resursfattiga regioner och bidra till begreppet sparsam vetenskap. En majoritet av proteinerna produceras för närvarande med hjälp av cellodlingssystem såsom rekombinanta Escherichia coli, jäst, däggdjursceller och växtceller för storskalig tillverkning, varefter de distribueras globalt från centraliserade gjuterier. Dock, den begränsade halveringstiden för dessa syntetiska proteiner kräver lagring vid låg temperatur och transportfaciliteter som är utmanande för patienter som bor i avlägsna och lågresursregioner.
I det nuvarande arbetet, Murphy et al. demonstrerade först enhetens arbetsprinciper genom att uttrycka och rena ett reporterprotein - grönt fluorescerande protein. Följt av användningen av TOC för att producera cecropin B - en antimikrobiell peptid som ofta används för att kontrollera biofilmsjukdomar. Forskarna syntetiserade och renade cecropin B framgångsrikt för att producera en koncentration av 63 ng/µL på sex timmar, med en renhet på 92 procent, följt av bekräftelse av dess antimikrobiella egenskaper med en tillväxtinhiberingsanalys. TOC-tekniken ger en ny plattform för syntes och rening av punkt-för-vård för tillgänglig klinisk terapi.
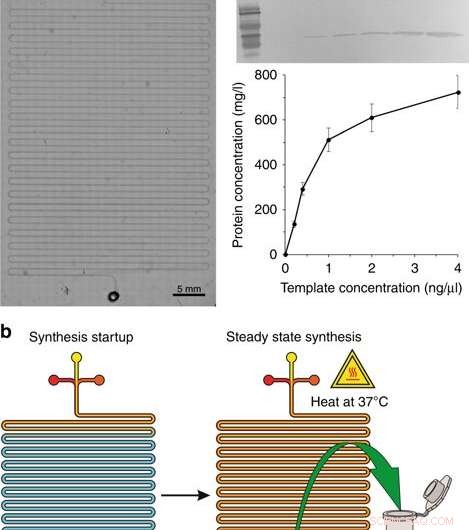
a) En mikroskopisk bild av syntesmodulen. b) Syntesstegen:syntesstart och steady state -syntes. c Western blotting av GFP producerat i CFPS -systemet och proteinutbytet med olika koncentrationer av plasmidmallen. Mus 6 × His tag monoklonal primär antikropp och HRP-konjugerad get anti-mus IgG (H+L) sekundär antikropp användes för att detektera målproteinet. Koncentrationer som anges är koncentrationerna i den slutliga reaktionsvolymen. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
De toppmoderna anordningarna som för närvarande används för proteinsyntes för användning inkluderar ett kylskåpssystem som sträcker sig över en tvådagars produktionsreningscykel för att tillverka 800 doser av ett läkemedel per dag. Men kapitalkostnaden för ett sådant system är inte genomförbar i utvecklingsländerna, där behovet av snabb produktion av massterapier för distribution uppväger massterapeutisk produktion för långtidslagring. I TOC -systemet utvecklat av Murphy et al. forskarna åstadkom punkt-av-vård syntes och rening av terapeutiska proteiner med hjälp av en cellfri proteinsyntes (CFPS) process. I detta system, rekombinanta proteiner uttrycktes utan användning av levande celler, lämplig för vårdproduktion, där frystorkade utgångsmaterial kunde förbli stabila under lagring över ett brett temperaturintervall.
Bland de proteiner som undersöktes i studien, cecropin B har en minsta hämmande koncentration på 9,5 ng/µL för att utöva antimikrobiella effekter. Med hjälp av mikrofluidisk inställning, forskarna kombinerade proteinsyntes och rening för att producera en antimikrobiell peptid cecropin B vid en kliniskt relevant dos (63 ng/µL). Produktionen av kontinuerligt flöde i installationen slutfördes i tre utvecklingsfaser:
Murphy et al. använt mjuklitografibaserad polydimetylsiloxan (PMDS) gjutning för att tillverka anordningarna; bygga flerlager med hjälp av mikromekaniska ventiler.
Under det första stadiet av enhetsdesign i CFPS -reaktorn, forskarna tillverkade ett serpentinkanal mikrofluidiskt chip, liknande tidigare studier för on-chip proteinsyntes. Mikrofluidanordningen innehöll inlopp anslutna till en sprutpump placerad på värmesteget i ett mikroskop, där tre inlopp mottog (1) celllysat, (2) CFPS -reaktionsbuffert och en (3) DNA -mall i den långa serpentinkanalen (cirka 130 cm) med ett utlopp. Forskarna matade de tre reaktionskomponenterna med en kombinerad flödeshastighet av 0,15 µL/min som drivs av en sprutpump under en uppehållstid på 1,5 timmar. De värmde reaktorn med en scenvärmare (37 grader C) och modellerade installationen med hjälp av COMSOL Multiphysics -programvara för att verifiera enhetens mekanik, för optimal blandning och reaktion på chip-diffusion. För att validera enhetens driftsprinciper, Murphy et al. syntetiserade reporterproteinet, GFP med olika DNA -mallar. Systemet producerade volymer protein vid en konstant reaktionstid.
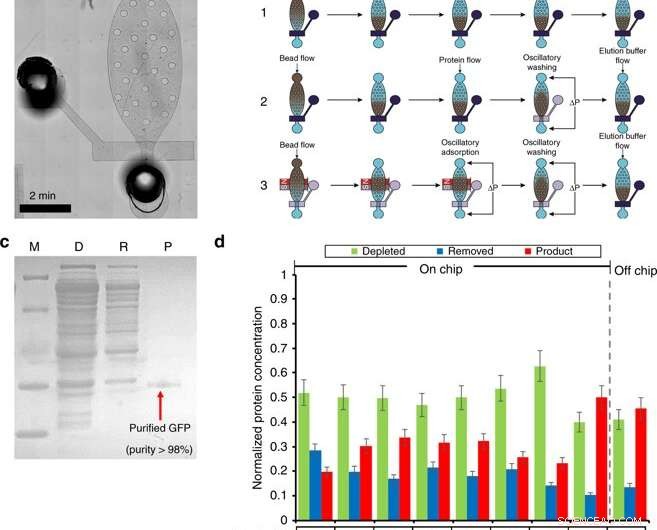
Proteinrening i en mikrofluidisk kammare. a) En mikroskopisk bild av reningsmodulen. b) Översikt över reningsförfarandet (inklusive fyllning av pärlor, sängbildning, proteinadsorption, tvättning, och eluering) med tre olika arbetsflöden. Workflow 1 använder flödesadsorption och tvättsteg. Workflow 2 använder flödesadsorption och oscillerande tvätt. Workflow 3 använder oscillerande adsorption och tvätt. Mörkblå betecknar en stängd ventil, där transparens betecknar en öppen ventil. c) SDS-PAGE av GFP renat med reningschipet. M (markör); D (utarmad):CFPS -reaktionsblandning efter pärlabsorption; R (borttagen):avlägsnade föroreningar i reningsbufferten; P (produkt):renad GFP i elueringsbufferten. d) Reningsstegsoptimeringen. Optimering genomfördes genom att undersöka 4 villkor. (1) Ni-NTA-pärlvolym av 5 eller 8 | il; (2) 0,5% Tween-20 tillsatt i renings- och elueringsbuffertar. (3) Olika arbetsflöden. (4) Olika oscillerande adsorptionstider. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8
I den andra fasen, Murphy et al. utformat en mikrofluidisk enhet för proteinrening baserad på ett högeffektivt adsorptions- och tvättprotokoll, som demonstrerats av samma forskargrupp tidigare. De manövrerade enheten med magnetventiler för att styra den enda mikromekaniska ventilen och tillhörande oscillerande tryckpulser för att utföra proteinrening i fyra stora steg.
I arbetsflödet, steg var (1) laddning av pärlor, (2) proteinadsorption, (3) tvätt och (4) eluering. För att optimera processen, forskarna delade in metoden till tre olika arbetsflöden. Murphy et al. varierade sedan villkoren som påverkade resultaten av proteinrening för att uppnå produktrenhet så hög som 98,5 procent, med ett utbyte på 54,6 procent av produkten, överträffar andra metoder.
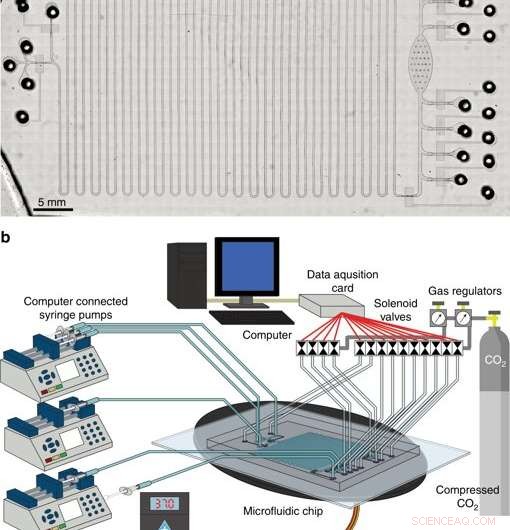
Det integrerade systemet för cellfritt proteinsyntes och rening. en mikroskop av integrerad CFPS+P -plattform. b Översikt över integrerad CFPS+P -plattformsinställning. Systemet består av datorstyrda magnetventiler och sprutpumpar anslutna till en mikrofluidanordning placerad på ett uppvärmningssteg. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8.
I fas tre, forskarna utvecklade en integrerad mikrofluidisk plattform med cellfri proteinsyntes och rening (CFPS+P) för automatisering. De kombinerade en kontinuerlig flödesreaktor och en satsreningsanordning, även om de två processerna inte var i grunden kompatibla med varandra till att börja med. För att uppnå tillräcklig kompatibilitet, de kopplade ihop de två processerna med hjälp av en rörreservoar som lagrade det kontinuerligt producerade proteinet på ett chip, före rening. Alla apparater som används i studien för att driva mikrofluidsystem kan eventuellt passa storleken på en portfölj, gör det till en mycket bärbar, terapeutiskt proteinproduktionssystem.
Totalt, det fullt integrerade CFPS+P -chipet innehöll fem stora steg inklusive, grundning, proteinsyntes, proteinadsorption, tvätt och eluering. I ett sjätte steg, forskarna arrangerade pärlauppfriskande. Murphy et al. använde serpentinesynteskanalen som den individuella syntesmodulen, efter att de syntetiserat den önskade mängden protein, de stängde av installationen från reningsmodulen för att påbörja den efterföljande reningsprocessen. För att testa arbetsflödet för installationen, forskarna använde GFP och uppnådde en renhet på 98 procent.
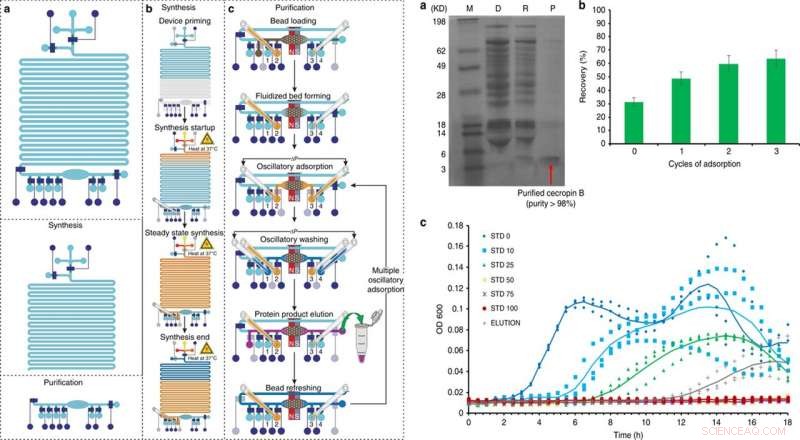
VÄNSTER:Översikt och drift av den integrerade cellfria proteinsyntes- och reningsplattformen i 5 stora steg:a) priming, b) proteinsyntes, c) proteinadsorption, tvättning, och eluering, med ett valfritt sjätte steg av pärluppfriskning. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8. HÖGER:Cecropin B -syntes och rening med integrerad CFPS + P mikrofluidisk enhet. a) Tricine-PAGE av cecropin B syntetiseras och renas av det integrerade chipet. M (markör); D (utarmat):CFPS -reaktionsblandning efter pärlabsorption; R (borttagen):avlägsnade föroreningar i reningsbufferten; P (produkt):renad AMP i elueringsbufferten. b) Optimering av cecropin B -återhämtning med hjälp av flera adsorptionscykler. c) Tillväxtinhiberingsanalyser av E. coli utförda i tre exemplar, använder proteinprodukten (eluering) efter tre adsorptions-/elueringscykler av vår enhet i jämförelse med cecropin B -standarder för olika koncentrationer (0–100 ng/μl, betecknas som STD 0-100). OD600 mättes var 30:e minut under 18 timmar. Eluering med en koncentration av 27 ng/μl i 60 μl lösning användes. Trendlinjer som representerar genomsnittet av tre försök läggs till för att styra ögat. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0051-8.
Efter CFPS+P -arbetsflödesoptimering med GFP, forskarna använde samma inställning för att optimera villkoren för att syntetisera cecropin B. Genom att följa uttrycksstegen, rening, elektrofores och färgning i installationen, Murphy et al. bekräftade framgångsrik produktion och rening av cecropin B och återvann lösliga proteiner för att eluera 63 ng/µL, med en renhet på 92 procent. De testade sedan bioaktiviteten för cecropin B relativt till E coli hämning för att visa framgångsrik antibiotisk aktivitet genom att hämma bakterietillväxt.
På det här sättet, terapeutiska proteiner syntetiserade och renade med hjälp av mikrofluiduppsättningen visade aktivt och effektivt undertryckande av bakterietillväxt. Det kostnadseffektiva systemet kan aktivt integreras i lågresursmiljöer för sparsam vetenskap. Murphy et al. har för avsikt att helt automatisera systemet baserat på pågående optimeringar i framtiden. De föreställer sig tillämpningar av installationen för att konstruera en rad olika terapeutiska proteiner för kostnadseffektiv vårdproduktion.
© 2019 Science X Network