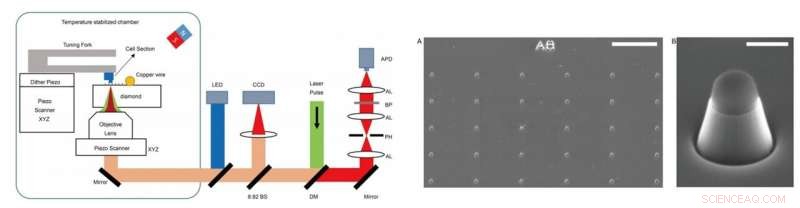
VÄNSTER - Experimentell uppställning. Experimentet utfördes på en hemmabyggd installation, som kombinerade optiskt detekterad magnetisk resonansmikroskopi (ODMR) med atomkraftsmikroskopi (AFM). DM:dikroisk spegel. BP:bandpassfilter som arbetar vid 650–775 nm. APD:lavinfotodiod. CCD:laddningskopplad enhet. LED:lysdiod på 470 nm. AL:akromatisk lins. PH:nålhål vid en storlek av 30 μm. BS:stråldelare. HÖGER - Bilder på nanopelarna på diamanter. (A) SEM-avbildning av de tillverkade diamantnanopelarna precis efter reaktiv jonetsning (RIE). Toppen av nanopelaren är täckt av väte silsesquioxan (HSQ) för att skydda NV-centret. (B) En enda trapetsformad cylinderformad nanopelare för att känna av cellsektioner vidhäftade vid AFM-spetsen. Skala staplar, 10 μm (A); 400 nm (B). Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
Inom livsvetenskap, förmågan att mäta fördelningen av biomolekyler inuti en cell in situ är ett viktigt undersökningsmål. Bland en mängd olika tekniker, forskare har använt magnetisk avbildning (MI) baserad på kvävevakanscentret (NV) i diamanter som ett kraftfullt verktyg i biomolekylär forskning. Dock, nanoskala avbildning av intracellulära proteiner har förblivit en utmaning hittills. I en färsk studie som nu publicerats i Vetenskapens framsteg , Pengfei Wang och kollegor vid de tvärvetenskapliga avdelningarna för fysik, biomakromolekyler, kvantinformation och biovetenskap i Kina, använde ferritinproteiner för att demonstrera MI-förverkligandet av endogena proteiner i en enda cell, använder kväve-vakans (NV) centrum som sensor. De avbildade intracellulära ferritiner och ferritin-innehållande organeller med hjälp av MI och korrelativ elektronmikroskopi för att bana väg för nanoskala magnetisk avbildning (MI) av intracellulära proteiner.
Att öka befintlig rumslig upplösning av biomedicinsk bildbehandling krävs för att uppnå pågående krav inom medicinsk bildbehandling, och därför, bland en mängd olika tekniker, magnetisk avbildning är av brett intresse för närvarande. Magnetisk resonanstomografi (MRT) används i stor utsträckning för att kvantifiera fördelningen av kärnsnurr, men konventionell MRI kan endast nå en upplösning på 1 µm vid kärnspinnavbildning där upplösningen begränsas av elektrisk detektionskänslighet. Forskare har utvecklat en rad tekniker för att bryta denna upplösningsbarriär, inklusive en supraledande kvantinterferensanordning och magnetisk resonanskraftmikroskopi. Ändå, dessa rapporter kräver en kryogen miljö och högt vakuum för avbildning, begränsa den experimentella implementeringen och dess översättning till klinisk praxis.
En nyligen utvecklad kvantavkänningsmetod baserad på kvävevakanscentret i diamant har radikalt flyttat gränsen för MI-tekniker på nanoskala för att upptäcka organiska molekyler och proteiner i labbet. Forskare har kombinerat kvantavkänning med NV-centra och skanningssondsmikroskopi för att demonstrera nanoskala MRI för enstaka elektronspin och små kärnspinnensemble medan de använder NV-centret som en biokompatibel magnetometer för att icke-invasivt avbilda ferromagnetiska partiklar i celler i subcellulär skala (0,4 µm). Till exempel, depolarisering av NV-centret kan användas som en bredbandsmagnetometer för att detektera och mäta fluktuerande brus från metalljoner och kärnspinn. Dock, sådan avbildning av enstaka proteiner via MI i nanoskala har hittills inte rapporterats i den enskilda cellen.
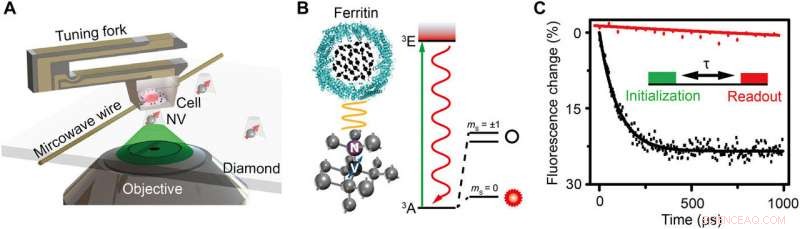
Schematisk uppställning och experimentell princip. (A) Schematisk bild av experimentuppställningen. Cellen inbäddad i harts är fäst vid en stämgaffel och skannar ovanför diamantnanopelaren som innehåller ett grunt NV-centrum. En koppartråd används för att leverera mikrovågspulsen till NV-centret. En grön laser (532 nm) från konfokalmikroskopet (CFM) används för att adressera, initiera, och läser upp NV-centret. (B) Vänster:Kristallgitter och energinivå för NV-centret. NV-centret är en punktdefekt som består av en substitutionell kväveatom och en intilliggande vakans i diamant. Till höger:Schematisk bild av ett ferritin. De svarta pilarna indikerar elektronsnurrarna för Fe3+. (C) Experimentell demonstration av detektering av spinbrus med och utan ferritin i form av polarisationsavklingning för samma NV-centrum. Insättningen är pulssekvensen för detektion och avbildning av ferritinet. En 5-μs grön laser används för att initiera spinntillståndet till ms =0, följt av en fri utvecklingstid τ för att ackumulera det magnetiska bruset, och slutligen läses spinntillståndet ut genom att detektera fluorescensintensiteten. Pulssekvensen upprepas cirka 105 gånger för att uppnå ett bra signal-brusförhållande (SNR). Relaxationstiden är anpassad till 0,1 och 3,3 ms genom exponentiell avklingning för fallet med och utan ferritin, respektive, indikerar ett spinnljud på 0,01 mT2. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
I detta arbete, Wang et al. rapporterade två tekniska framsteg för att möjliggöra MI i nanoskala av intracellulära proteiner i en enda cell. För detta, de fryste fast cellen till ett fast tillstånd och segmenterade den intrikat till en kubform, placerade den sedan på en avsökningssond med stämgaffel i ett atomkraftmikroskop (AFM) för avbildning, där cellens platta tvärsnitt exponerades för luft. Forskarna använde provplaceringsinställningen för att tillåta NV-sensorn att placeras inom 10 nm från målproteinerna och använde AFM för att undertrycka termisk drift under provpositionering. De konstruerade sedan trapetsformade cylinderformade nanopelare vid en bulkdiamantyta för bildinsamling, tekniskt förkortar tiden för bildinsamling med en order jämfört med tidigare metoder. I föreliggande studie, forskarna använde denna teknik för att utföra in situ MI av det magnetiska fluktuerande bruset från intracellulära ferritinproteiner (en biomarkör för järndepåer och transferrinmättnad i kroppen) inom experimentupplägget.
Ferritin är ett klotformigt proteinkomplex med en ytterdiameter på 12 nm, innehållande en hålighet som spänner över 8 nm i diameter som gör att upp till 4500 järnatomer kan lagras i proteinet. Det magnetiska bruset från ferrijonerna kan detekteras på grund av deras effekter på T 1 avkopplingstid för ett NV-center. I det här arbetet, Wang et al. bekräftade observationen med hjälp av fluorescensmätningar av tidsberoende sönderfall av populationen av NV-centra (magnetisk spinn, m S =0 tillstånd), i en diamantyta belagd med ferritiner. Dessutom, forskarna upptäckte det magnetiska bruset med etikettfria metoder med hjälp av NV-centret via transmissionselektronmikroskopi (TEM). Arbetet möjliggjorde utvecklingen av ett korrelerat MI- och TEM-schema för att erhålla och verifiera den första nanoskala MI av ett protein in situ.
Forskarna använde leverkarcinomcellinjen (HepG2) för experimenten och studerade järnmetabolism genom att behandla cellerna med ferriammoniumcitrat (FAC), vilket avsevärt ökade mängden intracellulärt ferritin. De verifierade detta med konfokalmikroskopi (CFM), western blotting och TEM-tekniker till en början. The results showed the primary localization of ferritins in the intracellular puncta around the nucleus, among the cytoplasm. The scientists used bulk electron paramagnetic resonance (EPR) spectroscopy to confirm the paramagnetic properties of ferritin in the FAC-treated HepG2 cells and mass spectroscopy to measure the interference due to other paramagnetic metal ions.
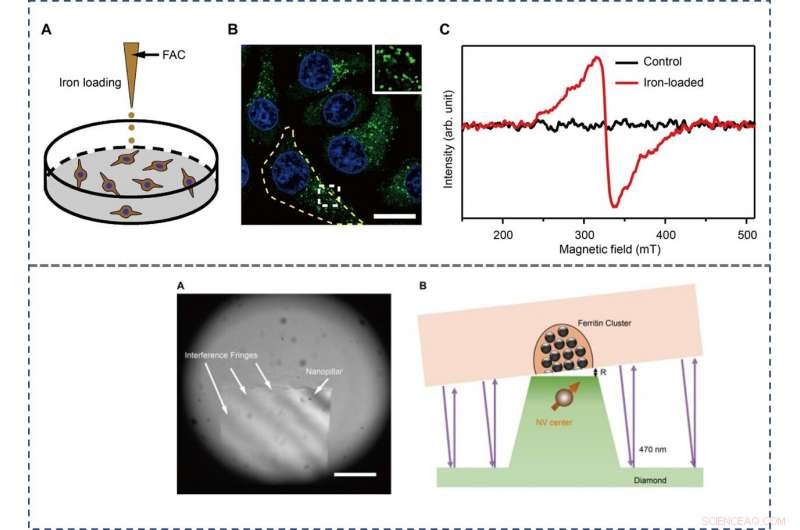
TOP - The preparation and characterization of ferritin-rich HepG2 cell samples. (A) Schematic view of the treatment to cultured cells. Following iron loading or no treatment, the HepG2 cells were examined for fluorescence images and EPR spectra, respektive. For the MI and TEM imaging, cell samples were treated through high-pressure freezing, freeze substitution, and sectioning. (B) Representative confocal microscopy (CFM) image of ferritin structures (green) in iron-loaded HepG2 cells. The ferritin proteins were immunostained by anti-ferritin light chain antibody. The nuclei are indicated by 4′, 6-diamidino-2-phenylindole (DAPI) in the blue channel. Inset displays magnified ferritin structures. The yellow dashed line outlines the contour of a cell. Skalstång, 20 μm. (C) EPR spectra of control and iron-loaded HepG2 cells at T =300 K. BOTTOM - Adjusting the distance between the NV center and the cell section. (A) Interference fringes between the cell cube and the diamond surface. Skalstång, 20 μm. (B) The geometric relation and the gap R between cell samples and diamond-pillars for MI. The top surface diameter of the nanopillar is 400 nm. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
Wang et al. then used ultrafast, high-pressure freezing to immobilize all intracellular components of the Fe-loaded cells. The process stabilized the intracellular structures and molecules by minimizing Brownian motion in cells, which typically contributes to random motion of proteins up to 100 nm in vivo. To image the samples, they embedded and polymerized the frozen cells in LR White medium, followed by gluing the embedded cell sample to the AFM tuning fork with a few cells at the tip. Using a diamond knife, the scientists then sectioned the tip surface to nanometer flatness to examine the cuboid cell section under AFM. They acquired MI images of ferritins by scanning the cell cube along the diamond nanopillars and simultaneously measured NV spin repolarization rate using the "leapfrog" scanning mode of the microscope as detailed previously.
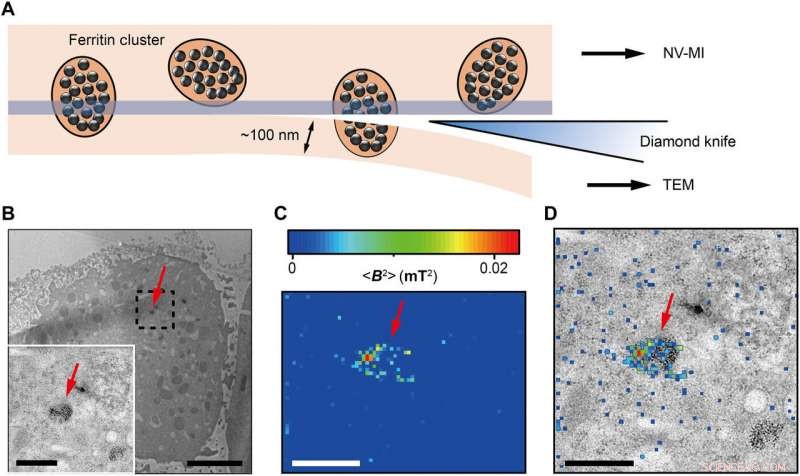
Correlative MI and TEM images. (A) Schematic view of sectioning for correlative MI and TEM imaging. The last section and the remaining cube were transferred for TEM imaging and MI scanning, respektive. The sectioning resulted in some split ferritin clusters that could be imaged under both microscopes. A transparent blue strip of ~10 nm indicates the imaging depth of the MI, while in the TEM, the imaging depth is ~100 nm. (B) Distribution of ferritins from the last ultrathin section under TEM. Inset:Magnified figure of the part in black dashed box. (C) MI result of the remaining cell cube. The pixel size is 43 nm. (D) The merged MI and TEM micrograph shows ferritins in a membrane-bound organelle. The red arrows in (B) to (D) indicate the same ferritin cluster. Skala staplar, 5 μm (B) and 1 μm [B (inset), C, and D]. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
The scientists measured fluorescence decay at a fixed free evolution time of 50 microseconds (τ =50 μs) to reveal the degree of NV sensor spin polarization, which correlated with the amount of ferritin in the sensing volume. They observed the appearance of some clusters via both TEM and MI images, although some details were not observed in MI, the results confirmed that spin noise from intracellular ferritin contributed to depolarize the NV center. In order to obtain details of the ferritin clusters at higher resolution, the scientists minimized the pixel size to 8.3 nm and acquired MI of high resolution of the proteins as expected.
På det här sättet, Wang et al. explored the sensitivity of NV centers as an appropriate sensor for biological imaging applications at the level of the single molecule. They used the technique as a sensor in the experimental setup to obtain the first MI of a protein at a resolution of 10 nm in situ. The scientists aim to improve the stability and sensitivity of the technique to speed up the scanning process and image a larger area of interest in the cell and locate ferritin beyond the nucleus in association with additional organelles.
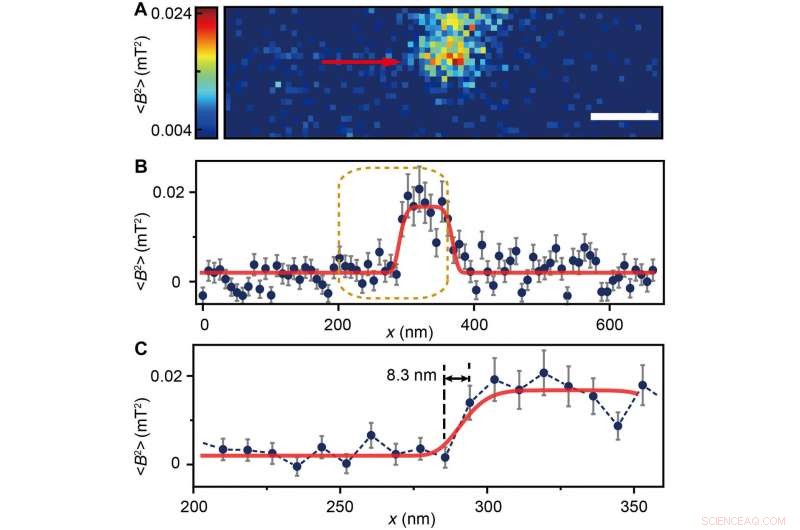
(A) Ferritin cluster imaged by the NV sensor with 80 × 24 pixels and a pixel size of 8.3 nm. Skalstång, 100 nm. (B) Trace data of the scanning line in (A) directed by the red arrow. The platform indicates the ferritin cluster. The red curve fitted by a plateau function serves as a guide to the eye. (C) Magnified figure of the gold dashed box in (B). The sharp transition indicated by the red arrow around x =283 nm shows the scanning from the blank area to the area with ferritins. Kredit:Science Advances, doi:10.1126/sciadv.aau8038.
The work will contribute to clinical diagnostics to determine biomarker-based iron storage and release in cells. This will include studies on the regulatory mechanisms of iron metabolism during the progression of hemochromatosis, anemi, liver cirrhosis and Alzheimer's disease. Wang et al. propose to extend the approach in situ to other cellular components with paramagnetic signals, including magnetic molecules, metalloproteins and special spin-labelled proteins. The scientists envision that further studies will explore additional targets suitable for high-resolution MI and correlated TEM imaging techniques, with optical microscopy detection incorporated to the experimental setup to extend the work and determine protein nuclear spin MRI as well as perform three-dimensional cell tomography.
© 2019 Science X Network