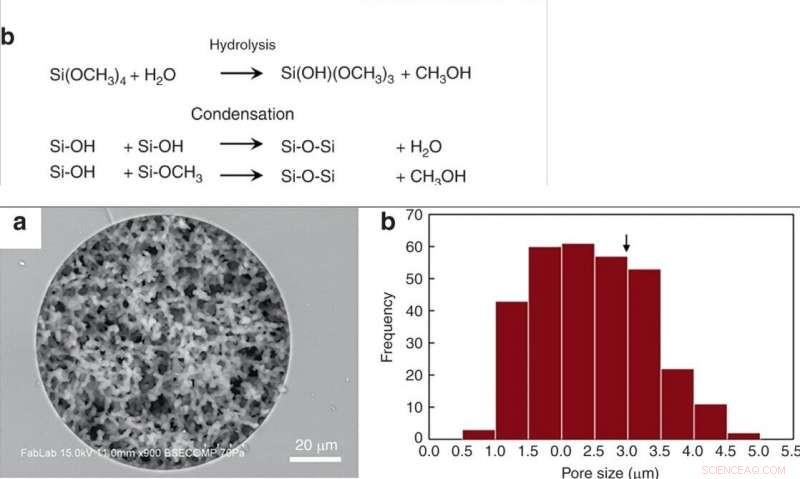
UPP:(a) Syntes av porös kiseldioxidmonolit i kapillär och termoplastisk form av smält kiseldioxid via sol-gel-kemi. (b) Konkurrerande reaktioner under syntesen av monolit. Silanolgrupper som finns på glaskapillär bildar kovalenta bindningar med monoliten under detta steg. NEDERST:(a) SEM-bild av en kiseldioxidmonolit syntetiserad inom en 100 μm ID smält kiseldioxidkapillär, avslöjar enhetlig porositet och utmärkt väggförankring av monoliten. (b) Histogram av porstorlek. Kritisk diameter för RBC-hemolys (2r*) är markerad med en pil. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Framväxande encellsdiagnostik förlitar sig på potentialen att snabbt och effektivt isolera bakterier från komplexa biologiska matriser. I en färsk studie som nu publicerats i Mikrosystem och nanoteknik , Jung Y. Han och kollegor vid de tvärvetenskapliga institutionerna för maskinteknik, Chemical Biomolecular Engineering och Bioengineering i USA utvecklade en enhet för att isolera intakta och livskraftiga bakterier från helblod med hjälp av en mikrofluid, porös kiseldioxidmonolit. De uppnådde mekanisk hemolys samtidigt som de tillhandahöll passage av intakta och livsdugliga bakterier genom monoliterna för storleksbaserad bakterieisolering och selektiv lysering. Han et al. beskrev en process för att syntetisera stora mängder av diskreta kapillärbundna monolitelement och monolitstenar i millimeterskala för att integreras i mikrofluidiska chips.
De undersökte effekten av monolitisk morfologi, geometri och flödesförhållanden på cellys och flödesregimer som möjliggjorde selektiv cellys och selektiv passage av flera gramnegativa och grampositiva bakterier. Tekniken som används av Han et al. tillåtet snabb provberedning och bakteriell analys i kombination med encellig Raman-spektrometri. Arbetet tillhandahåller unika provberedningssteg för att stödja snabb och odlingsfri bakterieanalys för tillämpningar i point-of-care biomedicinska apparater.
Bakterier i blodet kan leda till sepsis, infektion av vävnader och andra allvarliga medicinska tillstånd, kräver tidig identifiering av blodburna bakterier för effektiv behandling. Förmågan att snabbt identifiera bakterier med hjälp av point-of-care diagnostik kan avsevärt förbättra den kliniska potentialen för optimal behandling under infektion i tidigt skede. Den befintliga guldstandarden för bakteriell karakterisering är baserad på fenotypisk cellkulturanalys och kräver minst 24 timmar för att samla in prover för odling och analys i ett diagnostiskt och kliniskt mikrobiologiskt labb. Den befintliga tekniken är robust och billig men kan inte generera resultat i rätt tid för att vägleda de inledande stadierna av behandlingen.
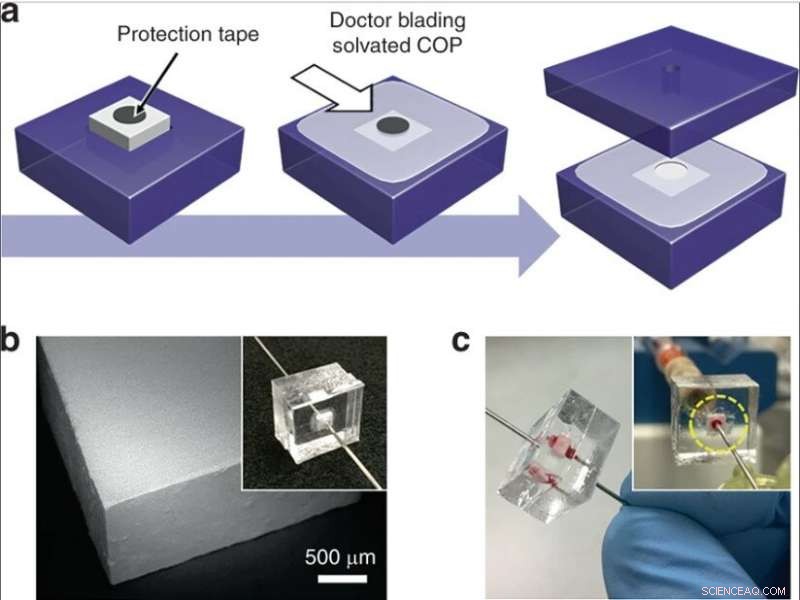
(a) Integrering av en kiseldioxidmonolitsten i ett termoplastiskt chip. En cirkulär tejp placeras på en monolit som sätts in i ett COP-substrat, och solvatiserad COP appliceras på den exponerade ytan. Efter delvis torkning, tejpen tas bort, enheten är omsluten av ett annat COP-substrat, och vätskeportar är införda i hål som tillhandahåller en flödesväg genom monoliten. (b) SEM-bild av en monolittegel som skärs av skivsåg. (c) Bild av en enhet under helblodsperfusion. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
I detta arbete, Han et al. utforskade mikrofluidiska enheter integrerade med porösa kiseldioxidmonoliter som enkla genomflödeselement för selektiv blodcellsanalys och intakt isolering av bakterier. Monoliter är mycket porösa material som består av öppen cellmorfologi med vridningsvägar för vätskeflöde. Forskare kan kontrollera monolitisk pormorfologi via hög mekanisk ytspänning under cellperfusion för mekanisk hemolys av blodkroppar, samtidigt som de tillåter intakta och livsdugliga bakterier att resa de slingrande flödesvägarna för deras odlingsfria isolering. Han et al. använde metoden för selektiv passage för bakterier i helblod under flödesförhållanden för grampositiva och gramnegativa arter, trots skillnader i bakteriestammarna. Tekniken med selektiv monolitlys med hög genomströmning i kombination med kraftfulla analytiska metoder som Raman-spektroskopi kan möjliggöra odlingsfri analys av bakterier i helblod på nivån av enskild cell.
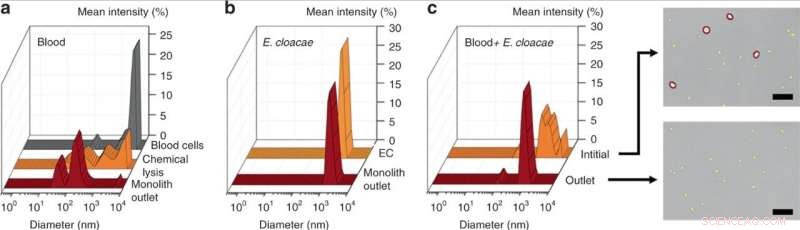
DLS-mätning av (a) initialt 25× utspätt blod, kemiskt lyserat blod, och blod lyserat genom perfusion genom monolitanordningen, avslöjar en signifikant minskning av cellavfallsstorleken för mekanisk monolitlys över kemisk lysis. (b) DLS-mätning av E. cloacae suspenderad i 1× PBS, och prov perfunderas genom monolitanordningen, visar ingen förändring i bakteriestorlek. (c) DLS-mätning av 100× utspätt blod spikat med E. cloacae, och prov uppsamlat från utloppet av en porös monolit. Den breda toppen i inloppsprovet indikerar en blandad population av blodceller och små bakterieceller, medan utloppsprovet visade signifikant minskning av stora (>2 µm) celler, som bekräftats i de optiska bilderna. Skalstaplar = 25 µm. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Han et al. modifierade tidigare rapporterade kiseldioxidmonolitsyntesprocesser, följt av hydrolys och kondensation av kiseldioxid för att bilda kiseldioxidglas vid låga temperaturer. För att förbereda kiseldioxidmonoliten, forskarna använde en prekursorlösning bestående av alkylsilikater, polyetylenglykol (PEG) som porogen, urea som en källa till hydroxyljoner för att minimera heterogenitet och ättiksyra. När de optimerade den syntetiska processen, de resulterande monoliterna var homogena och väl förankrade till kiseldioxidkapillärväggarna. Forskarna mätte tjockleken på den slutliga skelettmonolitens struktur och beräknade dess permeabilitet med hjälp av högpresterande vätskekromatografi för att kontrollera experimentella förhållanden. För att minimera inneboende variation, Han et al. skär de resulterande kapillärrören i 5 cm långa segment för att testa permeabiliteten före användning.
De utvecklade sedan två kompletterande metoder för drift med låg och hög genomströmning för att integrera kiseldioxidmonoliter i mikrofluidiska system. För att tillåta drift med låg genomströmning, forskarna bäddade in monolitinnehållande kapillärsegment i termoplastiska mikrofluidchip för att skydda monoliten under integrationen. För selektiv lysering med hög genomströmning använde de monoliter med större tvärsnittsareor inom mikrofluidanordningarna. Den kompletta tillverkningsmetoden gav utmärkt tillförlitlighet för läckagefri drift under helblodsperfusion.
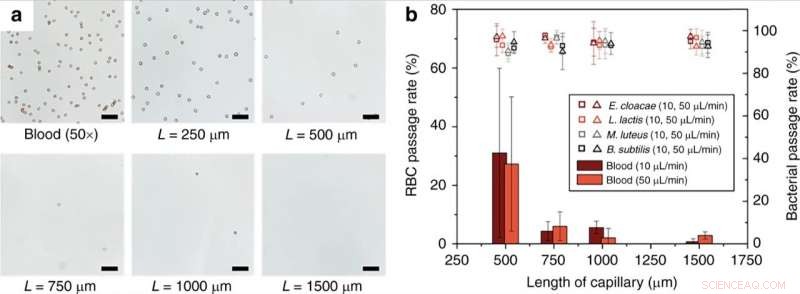
(a) Monolitlängdsberoende av RBC-hemolys. Totalt, 50× utspätt blod i 1× PBS perfunderades genom kapillärmonoliter av olika längder med en flödeshastighet av 10 μL/min. (b) Passagehastighet för RBC och livsdugliga bakterier vid olika flödeshastigheter och längder av monolitinnehållande kapillärer. Skalstaplar = 50 µm. Felstaplar är ±1SD. Kontrasten för optiska bilder justerades för synlighet. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4
Som bevis på principen, Han et al. valda Enterobacter cloacae (gramnegativ, stavformade bakterier) för att utforska deras passageeffektivitet, tillsammans med tre grampositiva bakterier; Lactococcus lactis, Micrococcus luteus och Bacillus subtilis. Under experimenten, de perfunderade bakterielösningar genom de mikrofluidiska monoliterna med varierande geometri och flödesförhållanden för att testa passagen av bakterier och blodcellslys med hjälp av dynamisk ljusspridning (DLS). Till exempel, perfusionen av renad E. cloacae genom monoliten gav inte märkbara förändringar i DLS-topparna, indikerar intakt passage av bakterier.
Forskarna visade effekten av längden på den porösa monolitanordningen på effektiviteten av lysering av röda blodkroppar (RBC). Resultaten visade att RBC-lyseffektiviteten ökade signifikant för monolitlängder över 1 mm. Han et al. studerade också ödet för vita blodkroppar (WBC) under driften av monolitanordningen, cellerna kunde inte passera genom monoliten utan att lyseras på samma sätt som RBC. Tekniskt, RBCs deformeras till en diskoid form för att passera genom monoliten, vilket orsakade avsevärt ökad membranspänning som resulterade i RBC-lys. Jämförelsevis, bakterieceller hade liknande dimensioner som monolitporerna och krävde därför mindre cellväggsexpansion för framgångsrik passage utan bristning. Forskarna optimerade enhetens parametrar för olika bakterier för att tolerera höga nivåer av membranstress utan bristning. Ytterligare utvecklingar säkerställde intakt passage av bakterier utan nedbrytning och med livsduglighet.
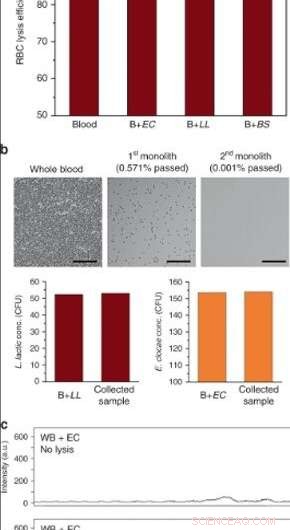
(a) RBC-lyseffektivitet av helblod i enheter med hög genomströmning efter perfusion vid 10 μL/min (EC E. cloacae, LL L. lactis, BS B. subtilis. Felstaplar är ±SD. N = 3 för blod och B + EC, och N = 2 för B + LL, B + BS. (b) Blodcellslys och bakterieseparation efter serieoperation med två monoliter. Ytor passiverades med BSA/Tween 20. Över 99,999% RBC-lys erhölls samtidigt som viabiliteten för L. lactis och E. cloacae bevarades. Skalstaplar = 100 µm. c Ramanspektra av helblod spetsade med E. cloacae (övre) före och (under) efter bearbetning genom porös kiseldioxidmonolit. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0063-4.
För bakteriell passage med hög genomströmning, forskarna spädde ut blodet i kapilläranordningarna. Dock, som ett alternativ, de skulle också kunna utöka monoliternas kapacitet för helblodslys. Enheterna behandlade mer än 400 µL helblod spetsad med bakterier innan de uppvisade en signifikant ökning av mottrycket, på grund av igensättning som ett resultat av cellys och även på grund av intakta leukocyter (WBCs) fångade i den porösa matrisen.
För att lokalisera målbakterier, Han et al. fick ett prov avsatt på en glasskiva, efter att den passerat genom monolitprocessen. De genomförde encellig Raman-analys genom att manuellt skanna den optiska sonden över provet. De förväntar sig användningen av selektiv lyseringsteknik, kopplat till konfokal Raman-mikroskopi i framtiden för att förbättra processen för att detektera bakteriestammar av intresse vid låga koncentrationer på en definierad plats av intresse.
På det här sättet, Jung Y. Han and colleagues developed a microfluidic monolith to efficiently isolate intact bacteria with wide-ranging theranostic, point-of-care potential for clinical applications. They envision the union of confocal Raman microscopy tools that are currently largely confined to the research lab with emerging miniaturized and handheld systems to pave the way towards rapid and portable point-of-care devices.
© 2019 Science X Network