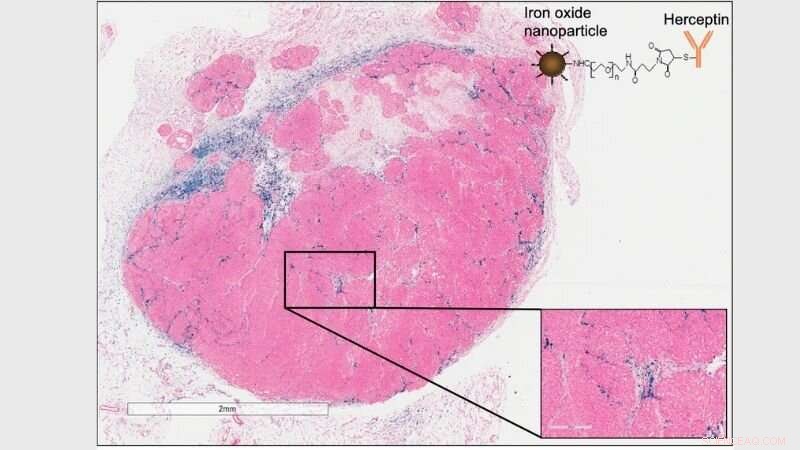
Histologi bild av HER2+ tumör som visar ackumulering av Herceptin-märkt nanopartikel (övre högra, och blå i histologi) ackumulering i tumörmikromiljö (immun) och inte på HER2+ cancerceller. Kredit:Robert Ivkov, Ph.D.
Forskare inom cancer -nanomedicin -samhället debatterar huruvida användning av små strukturer, kallas nanopartiklar, kan bäst leverera läkemedelsbehandling till tumörer passivt – så att nanopartiklarna diffunderar in i tumörer och hålls på plats, eller aktivt-lägga till en riktad anticancermolekyl för att binda till specifika cancercellreceptorer och, i teorin, behålla nanopartikeln i tumören längre. Nu, ny forskning om mänskliga och mustumörer hos möss av utredare vid Johns Hopkins Kimmel Cancer Center tyder på att frågan är ännu mer komplicerad.
Laboratoriestudier som testar båda metoderna i sex modeller av bröstcancer; fem humana cancercellinjer och en muscancer hos möss med tre varianter av immunsystemet fann att nanopartiklar belagda med trastuzumab, ett läkemedel som är inriktat på human epidermal tillväxtfaktorreceptor 2 (HER2)-positiva bröstcancerceller, hölls bättre kvar i tumörerna än vanliga nanopartiklar, även i tumörer som inte uttryckte HER2-proteinet för tillväxt. Dock, immunceller hos värden exponerade för nanopartiklar inducerade ett anti-cancer immunsvar genom att aktivera T-celler som invaderade och bromsade tumörtillväxt.
En beskrivning av arbetet publiceras den 25 mars Vetenskapens framsteg .
"Det har varit känt under lång tid att nanopartiklar, när det injiceras i blodomloppet, tas upp av scavengerliknande makrofager och andra immunsystemceller, " förklarar senior studieförfattare Robert Ivkov, Ph.D., M.Sc., docent i strålningsonkologi och molekylär strålningsvetenskap vid Sidney Kimmel Comprehensive Cancer Center på Johns Hopkins. "Många forskare inom området har fokuserat på att försöka minska interaktioner med immunceller, eftersom de har försökt öka cirkulationstiden för nanopartiklarna och deras kvarhållning i tumörceller. Men vår studie visar att immuncellerna i tumören samlar och reagerar på partiklarna på ett sådant sätt att stimulera ett anticancersvar. Detta kan ha potential att avancera bortom läkemedelsleverans mot att utveckla cancerimmunterapier."
Utredarna genomförde några in vitro-experiment i sin studie. Först, de applicerade några vanliga stärkelsebelagda järnoxid-nanopartiklar och andra belagda med trastuzumab på fem humana bröstcancercellinjer, fann att mängden bindning mellan de trastuzumab-belagda nanopartiklarna och cellerna berodde på hur mycket cancercellerna uttryckte onkogenen HER2. hos människor, HER2-positiva bröstcancer är bland de mest resistenta mot standard kemoterapi. Trastuzumab, säljs under namnet Herceptin, riktar sig mot de HER2-positiva tumörcellerna och utlöser också immunsystemet.
Svaren var förvånansvärt olika i djurmodeller, forskarna rapporterar. I separata experiment, teamet använde nanopartiklarna i två immundefekta stammar av möss ympade med celler från fem humana bröstcancercellinjer – två som var HER2-negativa och tre som var HER2-positiva. När de studerade djurens tumörer 24 timmar senare, de märkte att nanopartiklar belagda med trastuzumab hittades i en koncentration två till fem gånger större än de vanliga nanopartiklarna i alla typer av tumörer, oavsett om de uttryckte HER2-proteinet. De fann också att mängden trastuzumab-belagda nanopartiklar var ännu större (tiofaldigt) hos möss som hade ett fullt fungerande immunsystem och som hade tumörer som härrörde från mus.
Detta fick forskarna att misstänka att värddjurens immunsystem interagerade starkt med nanopartiklarna och spelade en roll för att bestämma kvarhållning av partiklarna i tumören, om ett läkemedel tillsatts eller inte.
Fler experiment, laget rapporterar, avslöjade att tumörassocierade immunceller var ansvariga för att samla in nanopartiklarna, och att möss som fötts upp med ett intakt immunsystem behöll mer av de trastuzumab-belagda nanopartiklarna än möss som fötts upp utan ett fullt fungerande immunsystem.
Dessutom, inflammatoriska immunceller i tumörernas omedelbara omgivning, eller mikromiljö, beslagtog mer av de belagda nanopartiklarna än de enkla. Till sist, i en serie 30-dagars experiment, forskarna fann att exponering för nanopartiklar hämmade tumörtillväxt tre till fem gånger mer än kontroller, och ökade CD8-positiva cancerdödande T-celler i tumörerna. Förvånande, Ivkov noterar, det anti-cancer immunaktiverande svaret var lika effektivt med exponering för antingen rena eller trastuzumab-belagda nanopartiklar. Möss med defekta T-celler visade inte tumörtillväxthämning. Utredarna säger att detta visade att systemisk exponering för nanopartiklar kan orsaka ett systemiskt värdimmunsvar som leder till immunstimulering mot cancer, och kräver inte att nanopartiklar finns inuti tumörerna.
"Övergripande, vårt arbete tyder på att det finns komplexa ömsesidiga beroenden mellan värdens och tumörens immunsvar på exponering av nanopartiklar, "Säger Ivkov." Dessa resultat erbjuder spännande möjligheter att utforska nanopartiklarnas "inriktning" på tumörimmunmiljön. De visar också spännande ny potential att utveckla nanopartiklar som plattformar för cancerimmunterapier."
Utredarna säger att de också planerar att studera om samma typer av immunsvar kan genereras för icke-cancertillstånd, såsom infektionssjukdomar.