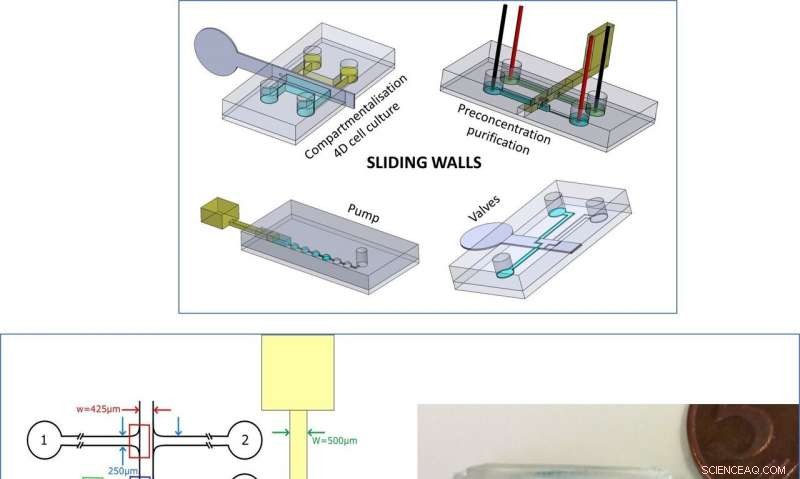
Överst:Sammanfattning av den nya tekniken. Vänster:Design av mikrochip och glidvägg för DNA -förkoncentration. Höger:Bild av mikrochip och glidvägg för fackdelningsexperiment. Blå och gula färgämnen har lagts till för visualisering. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
Ett forskargrupp utvecklade nyligen "glidväggar" som en ny teknik för vätskekontroll i mikrofluidiska enheter, låter halvstyva eller styva väggar glida inuti ett mikrofluidiskt chip. I en ny rapport nu Natur:Microsystems &Nanoengineering , Bastien Venzac och ett team av forskare vid Institute Curie och Sorbonne University i Paris, Frankrike, konstruerade flera fluidiska funktioner med hjälp av glidväggsgeometri. Enheten innehöll på/av -omkopplingsventiler för att blockera eller omkonfigurera kanaler beroende på vägggeometrin. Uppsättningen innehöll ett hydrogelbaserat membran för att koncentrera sig, rena och transportera biomolekyler från en kanal till en annan. Tekniken är kompatibel med mjuka litografimetoder för enkel implementering baserat på typiska tillverkningsarbetsflöden på polydimetylsiloxan (PDMS) chips. Den nya metoden öppnar en väg till en mängd olika mikrofluidiska applikationer, formar enkelt, handdrivna enheter för vårdapplikationer i biologiska laboratorier.
Verkligen omkonfigurerbara system är en mikrofluidics ingenjörs dröm, där ombyggnad beskriver smarta system inbyggda i modulenheter och monterade för snabb omorganisation mellan experiment. För de flesta mikrofluidiska system, dock, kanalnätverket förblir fast under mikrofabricering och kan inte anpassas om under experimentet. Ingenjörer kan också bara genomföra förändringar i pumpning, ventil eller använda externa krafter på elektricitet och magnetfält. För att möta de befintliga gränserna eller utmaningarna för mikrofluidproduktion, Venzac et al. föreslog ett nytt koncept för mikrofluidaktivering som kallas "glidväggar". Metoden är kompatibel med mjuklitografi men kräver ingen extern utrustning. Den kan manuellt manövreras och kan ingå i en enda enhetskomponent.
Venzac et al. utvecklat skjutväggar med flera tillverkningsmetoder för att konstruera dem inuti öppna kanaler av polydimetylsiloxan (PDMS) chips. Aktiveringsprocessen tillät dem att reversibelt öppna eller stänga en kanal som pumpar vätskor, omorientera sedan flöden för att omkonfigurera ett mikrofluidiskt nätverk efter behag. Teamet beskrev metodens princip och demonstrerade enkla funktioner inklusive bildandet av en hydrogelplatta för att rymma fyrdimensionell (4-D), kontrollerad cellodling, följt av membranbaserad elektrokinetisk DNA-förkoncentration i mikrofluidiska fack. De implementerade tekniken till låg kostnad för snabb prototypering och styrde manuellt glidväggarna för enkelhet, laget kunde också helt automatisera väggarna med hjälp av datorstyrda motorer eller ställdon. Den nya verktygslådan är väl anpassad för applikationer med mikrofluidkanaldimensioner över 100 µm och kräver bara få manöverdon.
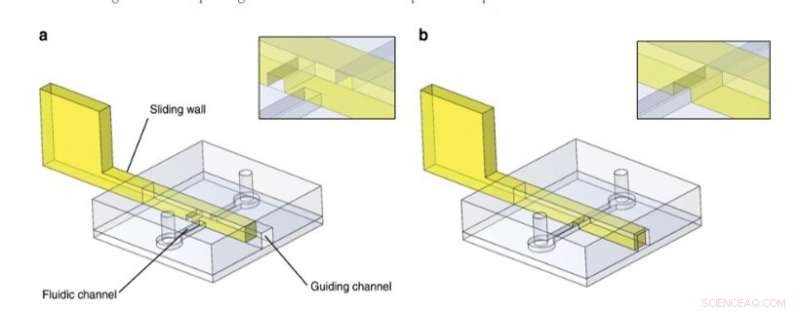
Glidväggsprincip. PDMS -strukturer innehåller en styrkanal och en fluidisk kanal och var bundna till en plan PDMS -yta. I det här exemplet, en glidvägg med en graverad kanal sattes in efter spånfabrikation inuti styrkanalen. Den fluidiska kanalen var blockerad eller b -fri. Detaljer om skjutväggen/vätskekanalskorsningen finns i insatserna. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
För den allmänna designprincipen, forskarna infogade en stel/halvstyv struktur i en styrkanal i PDMS mikrofluidiska chip och använde en mängd olika material för att utveckla glidväggar inklusive (1) filmer av rostfritt stål, (2) fothärdbart motstånd fotopolymeriserat i PDMS -formar, och (3) fotohärdbart harts gjutet med stereolitografisk 3D-tryckning. De valde de tekniska teknikerna för att passa experimentet efter deras inneboende egenskaper och förhindrade väggbockning eller sönderbrytning under aktivering genom att kontrollera materialstyvheten som föredrog rostfritt stål för de flesta tunna glidväggar. För större glidväggar använde de konventionell stereolitografi och använde mikrofräsning på rostfritt stål för att inkludera små funktioner på en glidvägg.
Som ett första proof-of-concept, Venzac et al. förberett två typer av ventiler:en på/av -ventil och en metallisk omkopplingsventil med ett inlopp och två utlopp. Glidventilerna är främst intressanta på grund av deras praktiska egenskaper i organ-på-chip-enheter och cellodlingskonstruktioner. Forskarna visade också användningen av glidande väggar som sprutor på chip för att manuellt pumpa vätskor och observerade inte vätskeläckage under tryckning eller sugning av luft i experimenten. Skjutväggarna var fyndiga för konstruktion av stora kammare - laget lade till två smala spår på kammartaket och golvet för att styra en vertikal glidvägg av rostfritt stål och reglera kommunikationen mellan facken.
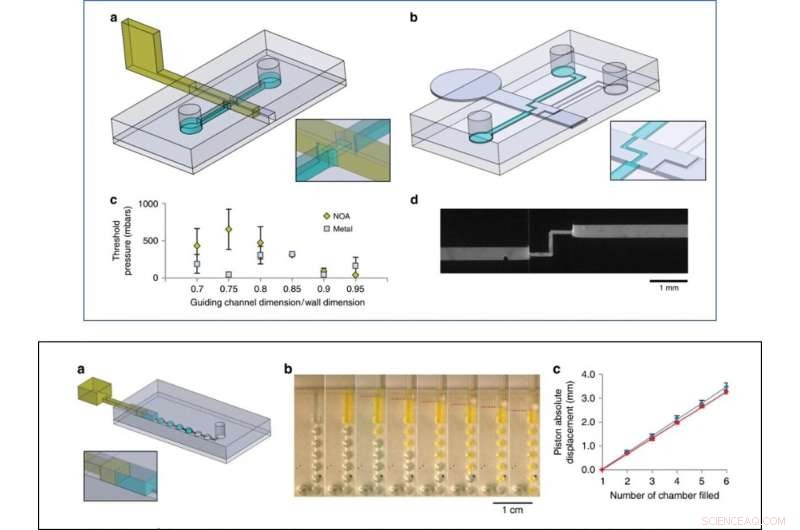
TOPP:Ventileringsförsök. a Design av chipet och den härdbara motståndsbaserade glidväggen för på-av-ventilförsöket. b Design av chipet och den metalliska glidväggen för omkopplingsventilförsöket. c Maximalt tryck motstått av resistbaserade (gula serier) och metallbaserade väggar (grå serie) för olika förhållanden mellan styrkanalen och glidväggens höjder och bredder (tre experiment per tillstånd). d Fluorescerande bild av omkopplingsventilen med fluorescein-fyllt vatten som strömmar genom den öppna banan (13 µl/s). BOTTOM:Pumpningsexperiment. en chipdesign, b Sekventiella bilder av pumpning av fluoresceinhaltigt vatten genom 1 µl kammare. Kolvens position anges med streckade röda linjer. c Flytande förskjutning kontra absolut kolvförskjutning (kolvens ursprung sattes vid början av fyllningen av den första kammaren), för att trycka (blått) och sedan dra (rött), i genomsnitt över fyra olika enheter. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
Teamet genomförde slutligen biofunktionaliseringstester med den nya enheten och observerade 4-D cellodling och cellmigration. I detta experiment, de laddade en fluorescerande kollagenlösning i den högra halvan av kammaren, fyllde den andra halvan med buffert och blandade de två för att skapa en hydrogelplatta. Sådana hydrogeler är ett viktigt krav för att utveckla 3-D-organ-på-chip-fack. För att testa deras biologiska funktion, Venzac et al. studerade cellmigration med dendritiska celler (immunceller) laddade i kollagenlösningen inuti en kammare. Teamet fyllde det andra facket med en kemokinlösning och tog bort den rostfria glidväggen för att skapa ett rakt gränssnitt så att kemoattraktanten kunde diffundera på kollagenplattan för att de dendritiska cellerna skulle migrera till gel/lösning -gränssnittet, bildande av en 4-D cellkultur.
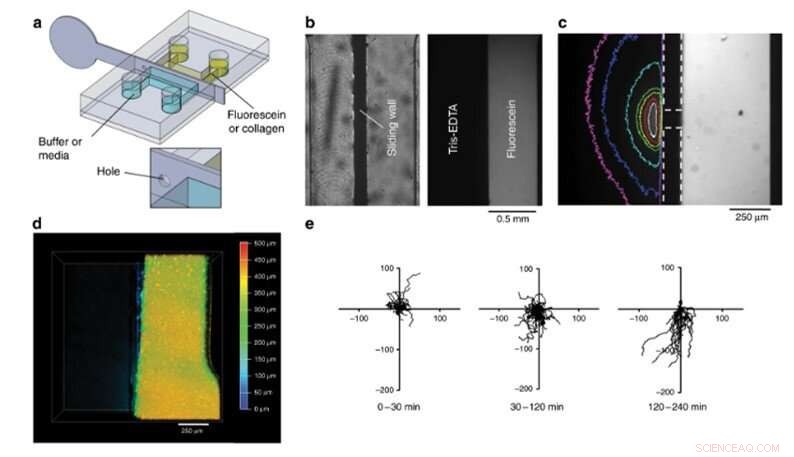
Kompartimentaliseringsexperiment. (a) Design av spån och metallisk glidvägg. (b) Ovanifrån bilder av ett förseglingstest. Vänster:ljus bild av kammaren. Höger:Fluorescerande bild av kammaren efter 8 timmar. (c) Fluoresceins gradient i Tris-EDTA-buffertfacket efter placering av ett 200 µm hål i glidväggen inuti kammaren. Glidvägg och hålgränser anges med de streckade linjerna. Färglinjerna motsvarar bildytan med en intensitet högre än 12% av maxvärdet (vit:1 s, röd:4 s, gul:9 s, grön:14 s, cyan:50 s, blå:110 s, magenta:170 s efter väggförskjutning). (d) ovanifrån, djupkodad konfokal bild av en fluorescerande, gelad kollagenplatta i höger, halva botten av kammaren efter avlägsnande av glidväggen. (e) Banor av dendritiska celler inuti kollagenplattan före avlägsnande av glidvägg (0–30 min) och efter avlägsnande av glidvägg (30–240 min) sönderdelas i två perioder. Den första visade ingen preferensmigration (30–120 min), medan celler lockas till kemokinkammaren från 120 till 240 minuter. Axlarna är i mikrometer, och den vertikala axeln pekar bort från kemokinfacket. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
De har också elektrokinetiskt förkoncentrerade DNA -makromolekyler, kontrollerade deras transport och släpp i den nya installationen. För att åstadkomma detta, laget använde ett rörligt och omkonfigurerbart hydrogelmembran i mikrofluidsystemet och konstruerade en glidvägg med ett integrerat fönster med högupplöst 3D-utskrift. De applicerade ett konstant elektriskt fält i kanalerna för att möjliggöra elektroforetisk migration av DNA-märkt med en fluorescerande tagg i buffertlösning. Storleken på hydrogelporerna förhindrade DNA -migration, vilket får dem att förkoncentrera sig vid membranet. Forskarna inducerade fritt flöde av förkoncentrerat DNA i installationen, för att transportera prover från en kanal till en annan, som en ny och enkel väg för provberedning och analys.
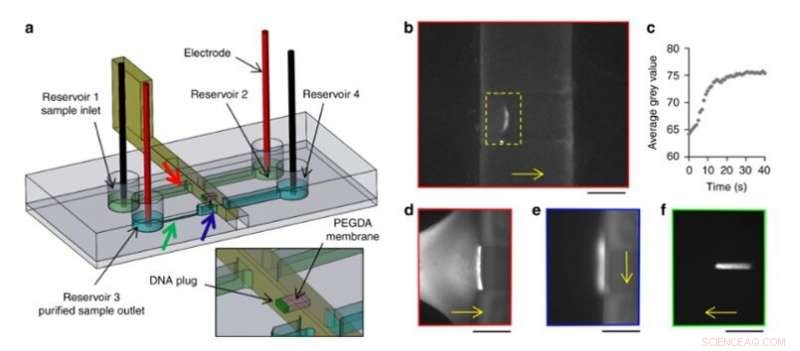
DNA -förkoncentration och reningsexperiment. (a) Design av spån och glidvägg. Ett PEGDA -membran (rosa) fotopolymeriserades i fönstret på en glidvägg. Färgade pilar anger platsen för följande bilder med motsvarande färgade kant. (b) Förkoncentration genom elektrofores av 100 pg Lambda-DNA mot PEGDA-membranet i en 3D-tryckt glidvägg. (c) Utveckling över tid av det genomsnittliga gråvärdet inuti den gula rektangeln av b). (d) Fluorescerande bilder av DNA under förkoncentration mot PEGDA -membranet, (e) efter förskjutning till den andra kanalen och (f) elektroforetisk frisättning. Skalstänger:250 µm. DNA -migrations- eller förflyttningsriktningar indikeras med de gula pilarna. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0125-7
På det här sättet, Bastien Venzac och kollegor utvecklade en ny verktygslåda för att förnya användningen av konventionell mikrofluidik. Skjutväggarna hade ytterligare funktioner som mikrokanaler eller fönster med laddade geler och lösningar för potentiella applikationer utöver de för konventionella in-chip-ventiler. I synnerhet, de uppnådde 4-D cellodling och DNA-förkoncentration med hjälp av den enda glidande väggkonfigurationen. Forskarna föreställer sig tekniken i breda tillämpningar för billiga och lågteknologiska biomedicinska miljöer.
© 2020 Science X Network