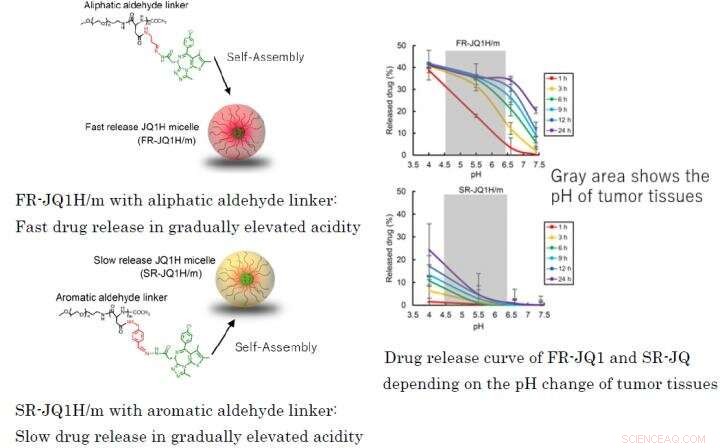
Fig. 1:Olika läkemedelsfrisättningsprofil beroende på länken som används för blocksampolymerer av nano-miceller FR-JQ1H/m med alifatisk aldehydlinker:Snabb läkemedelsfrisättning i gradvis förhöjd surhetSR-JQ1H/m med aromatisk aldehydlinker:Långsam läkemedelsfrisättning i gradvis förhöjd surhet Läkemedelsfrisättningskurva för FR-JQ1 och SR-JQ beroende på pH-förändringen av tumörvävnader Kredit:2021 Innovation. Centrum för NanoMedicine
Innovation Center of NanoMedicine rapporterade i ACS Nano tillsammans med gruppen av Prof. Yu Matsumoto från Otorhinolaryngology and Head and Neck Surgery och gruppen av Prof. Horacio Cabral vid Institutionen för bioteknik vid University of Tokyo att effekten av polymera nano-miceller med olika läkemedelsaktiveringsprofil beror på uttrycksnivå för c-Myc, en av de viktigaste proto-onkogenerna, har utvecklats.
Det är känt att c-Myc är involverat i cancercellsproliferation och angiogenes och förändrar cellcykeln, undertrycker normal celldifferentiering, och främjar cancermetastaser. Det är en typisk proto-onkogen som reglerar många gener relaterade till tillväxtfaktorer och som är känd för att vara involverad i utvecklingen av många cancerformer, såsom kromosomal translokation i Burkitt lymfom. Därför, forskning om läkemedelsupptäckt bedrivs över hela världen som ett läkemedel mot cancer som riktar sig mot denna transkriptionsfaktor som direkt kan attackera cancerstamceller. Dock, eftersom embryonal dödlighet inträffar i c-Myc knockout-möss, c-Myc anses vara en viktig gen för levande celler, och selektiv leverans till cancervävnader är en viktig nyckel för att utveckla dess inhibitorer. Förutom, c-Myc är också känd som en faktor som är nödvändig för den initiala induktionen av iPS-celler. I framtiden kan denna hämning förväntas tillämpas som en teknologi som också kan användas för att undertrycka iPS-cellhärledd karcinogenes.
I den här studien, JQ1H, som är en strukturell analog till JQ1H, en typisk indirekt c-Myc-hämmare, var inkapslad inuti funktionella nano-miceller, och deras effektivitet utvärderades. JQ1 binder till ett bromodomänprotein som kallas BRD4, som är involverad i aktiveringen av RNA-polymeras II som reglerar uttrycket av c-Myc, för att hämma denna ström kraftigt. Som ett resultat, aktiviteten av RNA-polymeras försvagas och c-Myc-uttrycket nedregleras. Även om JQ1 förväntades vara ett lovande epigenomläkemedel på grund av dess starka genuttryckshämning, det har en extremt kort halveringstid in vivo på grund av dess snabba njurutsöndring och snabba clearance efter administrering. Dessutom, JQ1 är nästan olösligt i vatten. Dessa egenskaper hos JQ1 blev stora problem för att utveckla det som ett effektivt läkemedel. De polymera nano-micellerna som hittills utvecklats vid Innovation Center of NanoMedicine (iCONM), för cancerbehandling, visat (1) stabilisering av inkapslade läkemedel, (2) undertryckande av njurutsöndring, (3) EPR (selektiv läkemedelsleverans till cancervävnader) medierad tumörackumulering, och (4) läkemedelsfrisättning baserat på tumöracidos. Den här gången, vi bekräftade god antitumöraktivitet hos möss transplanterade med tungcancer, melanom och cancer i bukspottkörteln med JQ1-utrustade nano-miceller.
övre:cancer i tungan, lägre:cancer i bukspottkörteln. Kredit:2021 Innovation Center of NanoMedicine
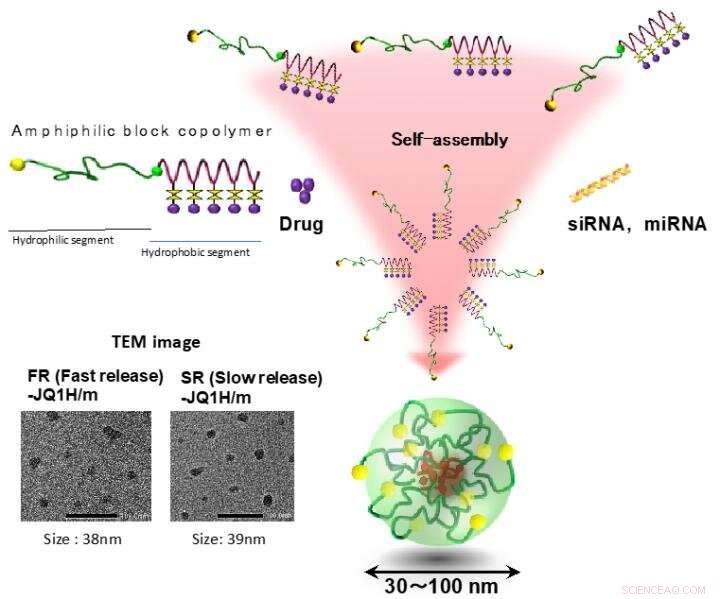
Polymera miceller var en av de första polymersjälvmonteringarna som rapporterades som en nano-DDS, och är sammansatta av distinkta två domäner, en läkemedelsladdningskärna och ett hydrofilt skal. Amfifila segmentsampolymerer, som innehåller ett hydrofilt block och ett hydrofobt block, avslöjas först för att konstruera dessa distinkta domäner i en micellstruktur genom spontan självmontering som ett resultat av hydrofoba interaktioner i vatten. H. Cabral, K. Miyata, K. Osada, K. Kataoka, "Blocka sampolymermiceller i nanomedicinska tillämpningar" Chem. Rev. 2018, 118 6844-6892. (DOI:10.1021/acs.chemrev.8b00199). Kredit:2021 Innovation Center of NanoMedicine
Nanomiceller innehållande JQ1H läcker in i tumörvävnaden från blodkärl efter systemisk administrering på grund av den så kallade EPR-effekten. Tumörvävnader är rika på mjölksyra på grund av dess förbättrade glykolys och är surare än normala vävnader. I det här arbetet, två typer av nano-miceller framställdes; en där hydrofob JQ1H var kopplad till en amfifil blockpolymer sammansatt av hydrofilt polyetylenglykolblock och hydrofobt polyaminosyrablock med användning av 3-aminopropionaldehyd (alifatisk aldehyd) länkare och den andra micellen där JQ1H var länkad med polymer via p-aminometylbensaldehyd ( aromatisk aldehyd) länkare. En amfifil blockpolymer syntetiserades och användes som basmaterial för nano-miceller. När det självmonterades i vatten till en micellär struktur och administrerades till cancerbärande möss, antitumöraktivitet uppnåddes.
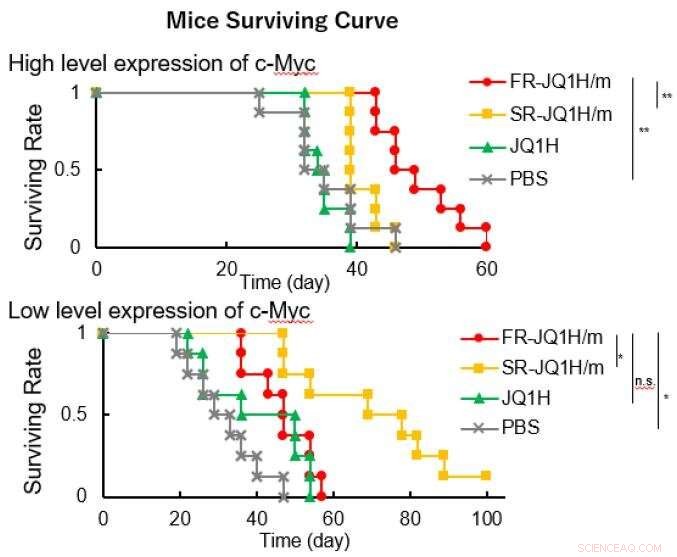
När länken är en alifatisk aldehyd eller när den är en aromatisk aldehyd, frisättningsmönstret för läkemedlet skiljer sig mycket beroende på surheten. Den förra släpper läkemedlet snabbt, och den senare frisätter läkemedlet långsamt. Därför, den förra nanomedicinen fick namnet FR-JQ1H/m och den senare fick namnet SR-JQ1H/m. Antitumöraktiviteten hos dessa nano-miceller skiljer sig mycket beroende på uttrycksnivån för c-Myc. Medan, FR-JQ1H/m är effektivare för tumörer med högt c-Myc-uttryck, SR-JQ1H/m är effektivare för tumörer med lågt c-Myc-uttryck.
I framtiden, vi tror att valet av nano-miceller enligt uttrycksnivån för biomarkörer kommer att vara ett viktigt steg mot förverkligandet av personlig medicin och kroppssjukhus.