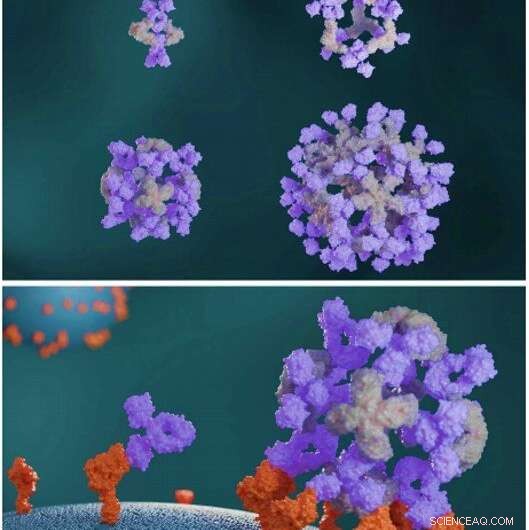
Designade proteiner sätter ihop antikroppar till stora symmetriska arkitekturer. Designade antikroppsklusterproteiner (ljusgrå) sätter ihop antikroppar (lila) till olika nanocage-arkitekturer (överst). Antikropps-nanokage förbättrar cellsignaleringen jämfört med fria antikroppar (nederst). Kredit:Vetenskap, doi:10.1126/science.abd9994
I en ny rapport som nu publiceras den Vetenskap , Robby Divine och ett tvärvetenskapligt forskarteam vid institutionen för biokemi, regenerativ medicin, och vacciner och infektionssjukdomar vid University of Washington U.S. och School of Medicine, vid Teheran University of Medical Sciences, Iran, genomförde beräkningsdesigner av nanocages för att sätta ihop antikroppar till exakta arkitekturer. Under byggandet, en strukturell komponent bildade en antikropp eller Fc-ligandfusion och den andra designen bildade en antikroppsbindande homo-oligomer för att driva nanocage-sammansättning med olika valenser och symmetri. Teamet antar hur denna process också kan öka neutraliseringen av ett pseudovirus; allvarligt akut respiratoriskt syndrom coronavirus-2 (SARS-COV-2) via α-SARS-COV-2 monoklonala antikroppar och Fc-angiotensinomvandlande enzym 2 (ACE-2) fusionsproteiner.
Antikroppar i medicinsk forskning
Antikroppar som specifikt binder till mål av intresse spelar en central roll i biomedicinsk forskning och medicin. Forskare kan generera kluster av antikroppar genom att genetiskt länka samman antikroppsfragment för att förbättra signaleringen. Det är för närvarande svårt att bilda antikroppssammansättningar med en mängd exakta arkitekturer och valenser. I det här arbetet, Divine et al. beräkningsdesignade proteiner som satte ihop antikroppar till exakta arkitekturer med olika valenser och symmetrier. Teamet antog att sådana konstruktioner robust skulle kunna driva godtyckliga antikroppar till homogena och strukturellt väldefinierade nanocages för uttalade effekter på cellsignalering. Forskarna designade proteiner för att driva sammansättningen av godtyckliga antikroppar till symmetriska sammansättningar med väldefinierade strukturer. För detta, de sammanfogade tre typer av "byggstens"-enheter som innehöll antikropps-Fc-bindande domäner, spiralformade repeterande kopplingar och cykliska oligomerbildande moduler. I sin arkitektur, den Fc-bindande enheten placerade sig med C2-antikroppsdimeren, den cykliska homo-oligomeren bildade den andra cykliska symmetriaxeln i nanocage, och den spiralformade upprepningskopplingen länkade antikropps- och cykliska homo-oligomersymmetriaxlarna i korrekt orientering för att bilda antikropparnanokage som hänvisas till som AbCs.
Antibody nanocage (AbC) design. (A) Polyedrisk geometri är specificerad. Medurs från övre vänster:icosahedral, dihedral, oktaedral, och tetraedriska geometrier visas. (B) En antikropps-Fc-modell från hIgG1 är anpassad till en av C2-axlarna (i detta fall, en D2 dihedron visas). (C) Antikropps-Fc-bindare fuseras till spiralformade repeterande kopplingar som sedan fuseras till den monomera subenheten av spiralformade cykliska oligomerer. Alla kombinationer av byggnadsblock och kopplingsblock av byggstenar samplas (gråskuggad botteninfällning; siffror inom parentes hänvisar till antalet tillgängliga byggstenar). (D) Trepartsfusioner kontrolleras för att säkerställa framgångsrik inriktning av C2 Fc-symmetriaxlarna med den för den polyedriska arkitekturen (i fallet med D2-symmetrin som visas här, C2-axlarna måste skära i 90° vinkel). (E) Fusioner som klarar de geometriska kriterierna går framåt med omdesign av sidokedjor, var, till exempel, aminosyror är optimerade för att säkerställa att kärnpackningsrester är opolära och tätt packade och att lösningsmedelsexponerade rester är polära. (F) Designade AbC-bildande oligomerer uttrycks bakteriellt, renat, och sammansatt med antikropp Fc eller IgG. Kredit:Vetenskap, doi:10.1126/science.abd9994 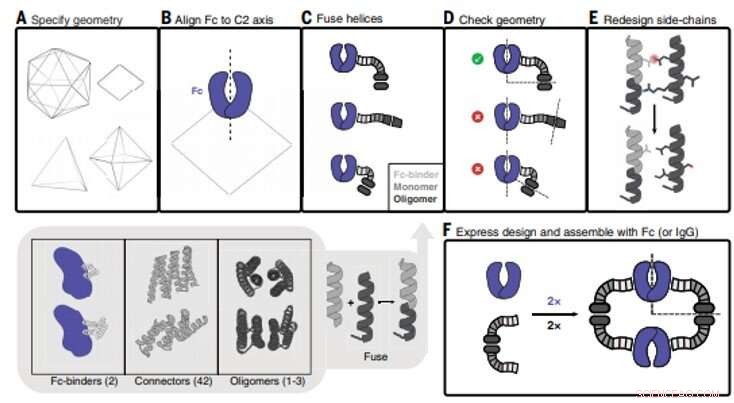
För att bilda antikroppsbur (AbC)-designer, Divine et al. styvt fuserade antikroppskonstanta domänbindande molekyler till cykliska oligomerer med användning av spiralformade spacerdomäner. De underlättade processen genom spiralformade distansdomäner så att symmetriaxlarna för den dimera antikroppen och den cykliska oligomeren kunde vara i orienteringar som genererade olika dihedriska eller polyedriska arkitekturer. Forskarna optimerade korsningsområdena mellan de anslutna byggstenarna för att vika till de designade strukturerna. Fusionsmetoden förlitade sig på stora uppsättningar av byggstenar med många möjliga fusionsplatser per byggsten som stränga geometriska kriterier för att bilda den önskade symmetriska arkitekturen. Teamet använde en beräkningsmetod för design av antikroppsburar för att generera dihedral, tetraedrisk, octahedral och icosahedral AbCs och använde en namnkonvention för att beskriva de slutliga nanocage-arkitekturen. Divine et al. därefter uttryckte syntetiska gener som kodar för designen i bakteriekulturer av Escherichia coli. Till exempel, de framgångsrika designerna inkluderade D-2 decahedral (tre mönster), T-32 (en design) och 152 icosahedral (två design) arkitekturer som innehåller två, sex, 12 eller 30 antikroppar, respektive. De karakteriserade Fc AbCs med hjälp av småvinklar röntgenspridning och elektronmikroskopi. De rekonstruerade nanocages var i nära överensstämmelse med beräkningsdesignmodellerna. För att bedöma stabiliteten hos nanocages, Divine et al. använde dynamiska ljusspridningsavläsningar för att erhålla uppmuntrande stabilitet för att möjliggöra karakterisering av deras biologiska påverkan nästa.
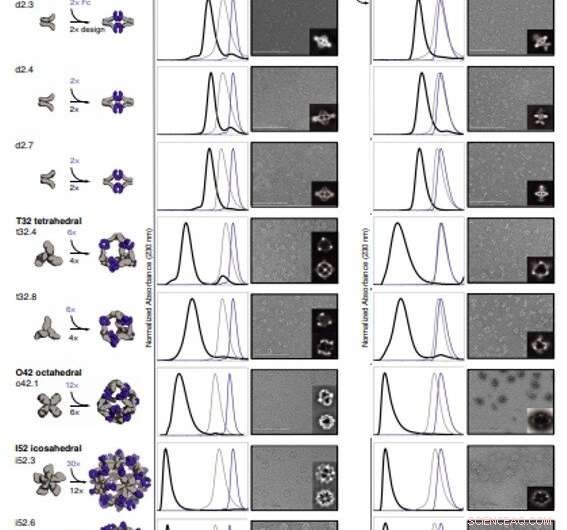
Strukturell karakterisering av AbCs. (A) Designmodeller, med antikropp Fc (lila) och designade AbC-bildande oligomerer (grå). (B) Överlagring av representativa SEC-spår av montering bildade genom att blanda design och Fc (svart) med de för de enskilda komponenterna i grått (design) eller lila (Fc). (C) EM-bilder med referensfria 2D-klassmedelvärden i infälld; all data är från NS-EM, med undantag för designerna o42.1 och i52.3 (cryo-EM). (D och E) SEC (D) och NS-EM representativa mikrofotografier med referensfria 2D-klassmedelvärden (E) av samma designade antikroppsburar sammansatta med fullt humant IgG1 (med de 2 Fab-regionerna intakta). I alla EM-fall som visas i (C) och (E), sammansättningar renades först via SEC, och fraktionerna som motsvarar toppen längst till vänster slogs samman och användes för avbildning för att avlägsna eventuellt överskott av design eller Ig-komponent. Skala staplar, 200 nm. Kredit:Vetenskap, doi:10.1126/science.abd9994
Effekter på cellsignalering
De designade AbCs gav en allmän plattform för att förstå effekten av valens och geometri av receptorengagemang på signalvägsaktivering. Det breda utbudet av receptorbindande antikroppar och naturliga ligander som bildas med AbC-metoden som utvecklats i detta arbete möjliggjorde en enkel och systematisk undersökning av effekten av geometri och valens av receptorsubenhetsassociation på cellsignalering för nästan vilken väg som helst. För att utforska det praktiska i detta tillvägagångssätt, Divine et al. sammansatta antikroppar eller Fc-ligandfusioner riktade mot en mängd olika signalvägar in i antikroppsburar (AbCs) och studerade deras inverkan på signalering. Till exempel, AbCs, bildad med en antikropp som riktar sig mot dödsreceptorn inducerad apoptos (celldöd) av tumörcellinjer som hittills förblivit opåverkade av den lösliga antikroppen eller den nativa liganden. Dessutom, sammansättning av Fc-fusioner eller antikroppar i AbCs, tillåtet förbättrad signalering av angiopoietinvägar, CD-40-signalering och T-cellsproliferation. AbC-bildningen möjliggjorde vidare neutralisering av ett in vitro-pseudovirus, såsom allvarligt akut respiratoriskt syndrom coronavirus 2.
3D-rekonstruktioner av AbCs bildade med Fc. Beräkningsdesignmodeller (tecknad representation) av varje AbC passar in i den experimentellt bestämda 3D-densiteten från EM. Varje nanocage ses längs en ledig symmetriaxel (vänster) och roteras för att titta ner på en av C2-symmetriaxlarna som upptas av Fc (höger). Tredimensionella rekonstruktioner från o42.1 och i52.3 är från cryo-EM-analys, alla andra är från NS-EM. Kredit:Vetenskap, doi:10.1126/science.abd9994 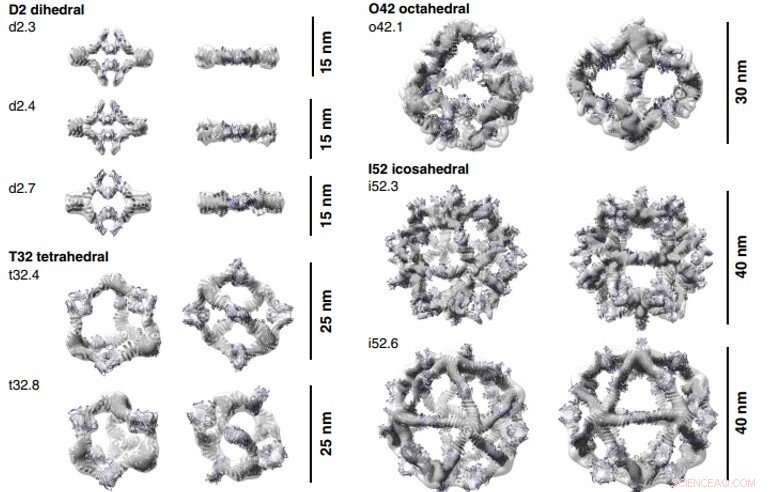
Metoden som beskrivs i detta arbete, gick utöver tidigare beräkningsdesigninsatser för att skapa proteinnanomaterial som integrerar form och funktion. AbCs använde därför antikroppar som både strukturella och funktionella komponenter för att uppnå ett brett spektrum av geometrier och orienteringar. Denna strategi är tillämpbar för att designa vacciner med nanocages sammansatta med virala glykoproteiner med hjälp av komponenter som slutar i glykoproteinbindande domäner för att maximera närheten till aktiva platser. På det här sättet, Robby Divine och kollegor designade flera antikroppsburbildande proteiner för att exakt klustera alla proteinbindande antikroppar i nanocages genom kontrollerad valens och geometri. Teamet använde två, sex och 12 eller 30 antikroppar i AbC genom att helt enkelt blanda antikroppen med motsvarande designade protein utan ytterligare kovalenta modifieringar. Forskarna lade till receptorbindande eller virusneutraliserande antikroppar i ABC för att förbättra deras biologiska aktivitet över olika cellsystem. Teamet förväntar sig att detta resultat för snabb antikroppssammansättning inom beställda nanocages utan kovalenta modifieringar kommer att ha breda tillämpningar inom forskning och medicin.

AbCs aktiverar signalvägar för apoptos och angiogenes. (A och B) Caspase-3/7 aktiveras av AbCs bildade med a-DR5-antikropp (A), men inte den fria antikroppen, i RCC4 njurcancerceller (B). (C och D) a-DR5 AbCs (C), men inte Fc AbC-kontroller (D), minska cellviabiliteten 4 dagar efter behandling. (E) a-DR5 AbCs minskar livskraften 6 dagar efter behandling. (F och G) o42.1 a-DR5 AbCs förbättrar PARP-klyvning, en markör för apoptotisk signalering; (G) är en kvantifiering av (F) i förhållande till PBS-kontroll. (H) The F-domain from angiopoietin-1 was fused to Fc (A1F-Fc) and assembled into octahedral (o42.1) and icosahedral (i52.3) AbCs. (I) Representative Western blots show that A1F-Fc AbCs, but not controls, increase pAKT and pERK1/2 signals. (J) Quantification of (I):pAKT quantification is normalized to o42.1 A1F-Fc signaling (no pAKT signal in the PBS control); pERK1/2 is normalized to PBS. (K) A1F-Fc AbCs increase vascular stability after 72 hours. (Left) Quantification of vascular stability compared with PBS. (Right) Representative images; scale bars, 100 mm. All error bars represent means ± SEM; means were compared using analysis of variance and Dunnett post-hoc tests (tables S8 and S9). *P ≤ 0.05; **P ≤ 0.01; ***P ≤ 0.001; ****P ≤ 0.0001 Credit:Science, doi:10.1126/science.abd9994
© 2021 Science X Network