Den begränsande faktorn vid cancerstrålbehandling är att doser som är tillräckligt höga för att försöka bota tumörer också skadar omgivande normala vävnader. Upphovsman:Shutterstock
Cancer är den näst vanligaste dödsorsaken i världen. Under 2018, det fanns 18,1 miljoner nya fall och 9,5 miljoner cancerrelaterade dödsfall över hela världen. Senast 2040, antalet nya cancerfall per år förväntas stiga till 29,5 miljoner och antalet cancerrelaterade dödsfall till 16,4 miljoner.
Ungefär 50 procent av alla cancerpatienter kan dra nytta av strålbehandling i behandlingen av sin sjukdom. Ungefär hälften av dessa patienter diagnostiseras tillräckligt tidigt för att deras cancer kan botas. För många cancerformer inklusive bröst, prostata, cervix, huvud och nacke, lung- och hjärncancer, kurativ behandling inkluderar strålbehandling. Dock, eftersom strålbehandling förstör såväl friska celler som tumörceller, doserna är begränsade.
Strålbehandling, även kallad strålbehandling, används ensamt för att behandla cancer eller tillsammans med andra behandlingsalternativ som kemoterapi och kirurgi. Det kan också användas för att krympa tumören före operation. Inom strålbehandling, tumörceller - som delar sig mycket snabbare än andra omgivande friska celler - förstörs genom att skada deras DNA.
Biverkningar begränsar stråldosen
Den begränsande faktorn vid strålbehandling är att doser som är tillräckligt höga för att försöka bota högrisk (lokalt avancerade) icke-metastaserande tumörer också skadar omgivande normala vävnader. För närvarande, vi är vid gränsen för strålbehandlingsdos som kan ges till patienter. För att ytterligare förbättra överlevnaden, det finns ett behov av nya metoder som förbättrar strålningseffektiviteten och samtidigt minskar biverkningarna.
Ett sätt att åstadkomma detta är att göra tumörceller mer känsliga för strålning, så dessa celler skadas lättare av strålbehandling. Att använda guldnanopartiklar som radiosensibilisatorer har visat lovande resultat. Dessa guldnanopartiklar kan införas intravenöst för att ackumuleras i tumören genom att utnyttja de felaktiga väggarna i tumörens blodkärl, som tenderar att vara läckande på grund av snabb tillväxt.
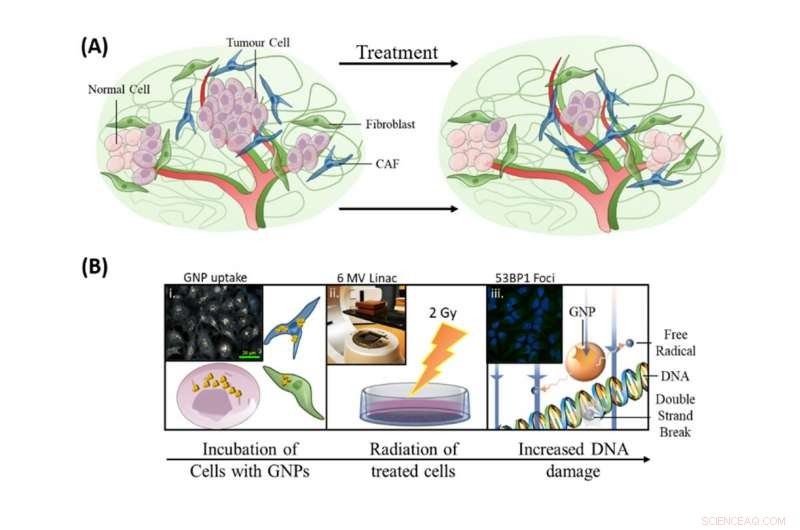
Att införliva guldnanopartiklar i nuvarande strålbehandlingsprotokoll hade tre mål:att förbättra dödandet av tumörceller, för att rikta in sig på CAF och för att skydda fibroblaster. Kredit:Bromma et al.(2020), Vetenskapliga rapporter, 10, 2181., Författare tillhandahålls
Guldnanopartiklar interagerar med röntgenfotoner som används vid strålbehandling som producerar elektroner, som sedan interagerar med vattenmolekyler för att producera fria radikaler. Dessa fria radikaler kan skada celler, sänker överlevnaden för dessa celler.
Att förstå det komplexa biologiska systemet som finns i och runt tumören är avgörande för att optimera användningen av radiosensibiliserande BNP, som beskrivs av ett konsortium av labb, inklusive vårt eget laboratorium för nanovetenskap och teknikutveckling vid University of Victoria.
Inriktning på interaktioner inuti tumören
I det här arbetet, vi diskuterar vikten av att undersöka vilka cellulära komponenter inom tumörens mikromiljö som tar upp guldnanopartiklarna och blir radiosensibiliserade. Vi är särskilt intresserade av celler som kallas aktiverade fibroblaster, som är förknippade med sårläkning och har antitumörogena egenskaper, vilket betyder att de hjälper till att bekämpa tumörtillväxt.
Dock, aktiverade fibroblaster kan rekryteras av tumörcellerna, och bli cancerassocierade fibroblaster (CAF). Istället för antitumörframkallande egenskaper, CAF främjar spridning och metastasering av tumörer.
CAFs funktion stöder tanken att tumörer är "sår som inte läker, " och inriktning på CAF kan visa sig vara fördelaktigt för förbättrade cancerbehandlingsresultat.

Ansamling av guldnanopartiklar (röda) i tumörmiljön. Kredit:Bromma et al.(2020), Vetenskapliga rapporter, 10, 2181., Författare tillhandahålls
Som illustreras i bilden ovan, vår forskning om att införliva guldnanopartiklar i nuvarande strålbehandlingsprotokoll hade tre mål:att förbättra dödandet av tumörceller, för att rikta in sig på CAF och för att skydda fibroblaster.
För att strålsensibilisering ska vara effektiv för att förbättra strålbehandling, cellerna som behandlingen riktar sig till (de som är förknippade med cancertillväxt) måste ha högt upptag av de radiosensibiliserande partiklarna, medan de nyttiga cellerna behöver ha ett lågt upptag. Detta gör att målcellerna lättare förstörs av strålbehandling i doser som patienter kan tolerera.
Dessa resultat med användning av 3D-tumörer odlade i labbet är mycket uppmuntrande. CAF:erna hade det största upptaget av guldnanopartiklarna per cell, med nästan tre gånger så stor som cancerceller, medan fibroblaster hade ett relativt litet antal. Detta översattes också till en större ökning av DNA-skador i CAF jämfört med de andra celltyperna, minska aktiviteten hos CAF och bromsa tumörtillväxt.
Denna skillnad i DNA-skada på grund av selektiv inriktning av cancerassocierade celler över normala celler kan tillåta guldnanopartiklar att vara ett effektivt verktyg i framtida cancerstrålbehandling, hjälper till att minimera skador på normal vävnad samtidigt som den lokala strålbehandlingsdosen för tumören förbättras.
Denna studie visar att användning av guldnanopartiklar som radiosensibilisator gör att mer skada kan spridas till CAF, ett element som har visat sig vara i hög grad inflytelserik för utvecklingen av cancer. Vi tror att detta arbete kommer att vara en byggsten mot en mer effektiv behandlingsregim inom en snar framtid. Att bygga en modell som exakt kan representera de olika interaktioner som äger rum i tumörens mikromiljö är avgörande för att förbättra behandlingsresultaten för patienter.
Denna artikel publiceras från The Conversation under en Creative Commons -licens. Läs originalartikeln. 