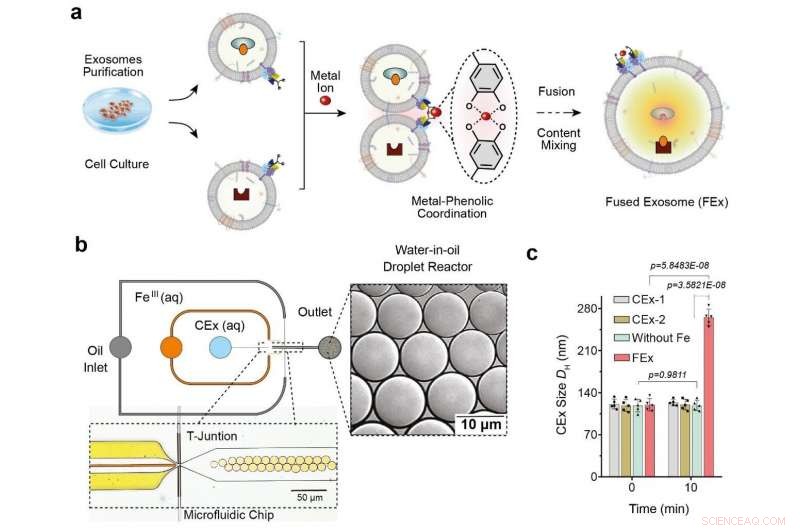
(a) Fe3+-jon utlöser membranfusion i exosomer skräddarsydda med katekol (CEx). Bildandet av ett metall-katekolkomplex bringar exosomerna nära varandra och möjliggör fusion. Olika reaktanter i varje exosom inkapslas sedan tillsammans, främjar blandning och utlöser reaktioner inuti de sammansmälta exosomerna (FEx). (b) Mikrofluidanordningen utformad för att generera vatten-i-olja droppreaktorer vid den flödesfokuserande korsningen. De två vattenhaltiga faserna (CEx och metallsalt) möts och levereras till oljeströmmen (1 % ytaktivt ämne PFPE-PEG i FC-40) för att bryta vätskan till droppar. (c) Genomsnittlig storlek på icke sammansmälta exosomer (CEx-1:121 ± 8 nm, CEx-2:123 ± 5 nm) och sammansmälta exosomer (FEx:265 ± 14 nm). Kredit:Institutet för grundvetenskap
Celler har små fack som kallas organeller som utför komplexa biokemiska reaktioner. Dessa fack har flera enzymer som arbetar tillsammans för att utföra viktiga cellulära funktioner. Forskare vid Centrum för mjuk och levande materia inom Institutet för basvetenskap (IBS, Sydkorea) har framgångsrikt efterliknat dessa rumsliga fack i nanoskala för att skapa "konstgjorda mitokondrier." Studien publiceras i Naturkatalys som omslagsartikel. Forskarna konstaterar att tekniken kan användas för att konstruera konstgjorda organeller som kan leverera ATP eller andra användbara molekyler till celler i skadade eller sjuka vävnader.
Detta uppnåddes genom omprogrammering av exosomer, som är små vesiklar (diameter ~120 nm) som celler använder för intercellulär signalering. Forskarna utförde experimenten med mikrofluidiska droppreaktorer, som genererade små droppar som var av liknande storlek som typiska celler. (diameter ~10 μm) Forskarna syftade först till att underlätta kontrollerad fusion av dessa exosomer i dropparna samtidigt som de förhindrade oönskade fusioner.
De åstadkom detta genom att skräddarsy exosomytorna med molekyler som kallas katekol, som är ett kelatbildande medel som bildar komplex med metalljoner. Detta gjordes i sin tur genom att fästa katekolen på antikroppar som riktar sig mot specifika cellmarkörer, som CD9. Katekols komplexbildande egenskap gör att de kan driva fusioner mellan exosomer när de blandas med metalljoner som Fe 3+ . Membranfusionen uppstår när katekolerna på ytorna binder till järnet och bringar vesiklarna nära varandra.
Forskare testade först effektiviteten av detta system genom att ladda en typ av exosomer med calcein-Co 2+ och en annan med EDTA. När de två vesiklarna smälter samman och innehållet blandas, EDTA tar tag i Co 2+ borta från kalcein, vilket sedan låter den senare fluorescera. Teamet insåg att de var framgångsrika vid upptäckten av fluorescenssignalen, och fusionen bekräftades ytterligare genom fördubblingen av den uppmätta exosomdiametern.
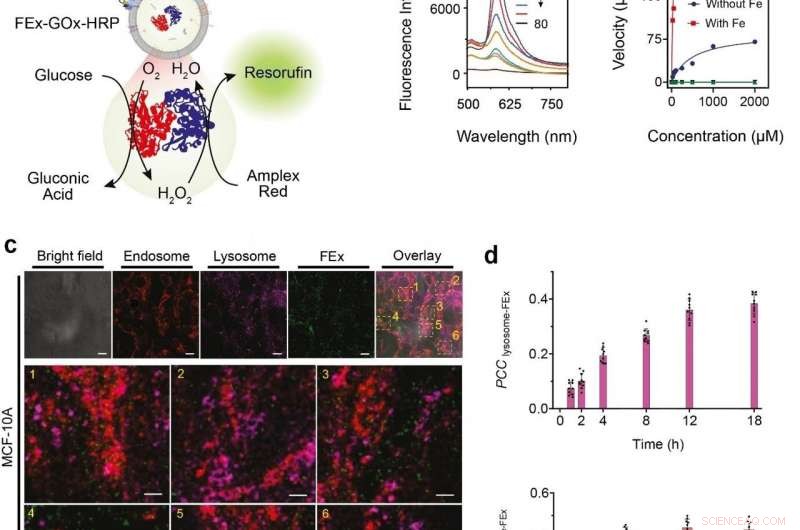
(a) Schematisk representation av ett tvåenzym GOx/HRP CEx som smälter in i FEx. Den katalytiska reaktionen initierades genom att tillsätta glukos, genererar H2O2 genom aerob oxidation, som sedan användes för att oxidera Amplex Red för att generera resorufin. (b) Representativa fluorescensspektra av resorufin som genereras genom biokatalys i fusionerade exosomer (FEx-GOx-HRP) vid olika tidpunkter. Reaktionshastighet för nanoreaktorn vs glukoskoncentration för att beräkna kinetiska konstanter genom att anpassa Michaelis-Menten-ekvationen. (c) Stabilitet och integritet av FEx-GOx-HRP efter cellulär integration efter 48 timmar. Endosomer (EEA1, röda) lysosomer (LAMP1, magenta), och FEx (grön) visas. (d) Plott av Pearsons korrelationskoefficient (PCCLysosome-FEx) värden över tid för magenta (lysosom) och grön (FEx) fluorescens, och för röd (Endosom) och grön (FEx) fluorescens. Kredit:Institutet för grundvetenskap
Dessa skräddarsydda exosomer laddades sedan med olika reaktanter och enzymer, som gjorde dem till biomimetiska nanofabriker. Detta tillåter dem att producera högvärdiga biomolekyler genom att utföra önskade biokatalytiska transformationer på ett spatialt begränsat sätt vilket inte är möjligt med konventionella laboratorieprovrör. Teamet visade denna multienzym biokatalytiska kaskadfunktion genom att kapsla in glukosoxidas (GOx) och pepparrotsperoxidas (HRP) inuti exosomer. GOx omvandlar först glukos till glukonsyra och väteperoxid. HRP använder i sin tur väteperoxiden som genereras i den första reaktionen för att oxidera Amplex Red till en fluorescerande produkt, resorufin. Forskarna kunde till och med ta ett steg längre genom att lägga till ett tredje enzym, galaktosidas som omvandlar laktos till glukos, i blandningen.
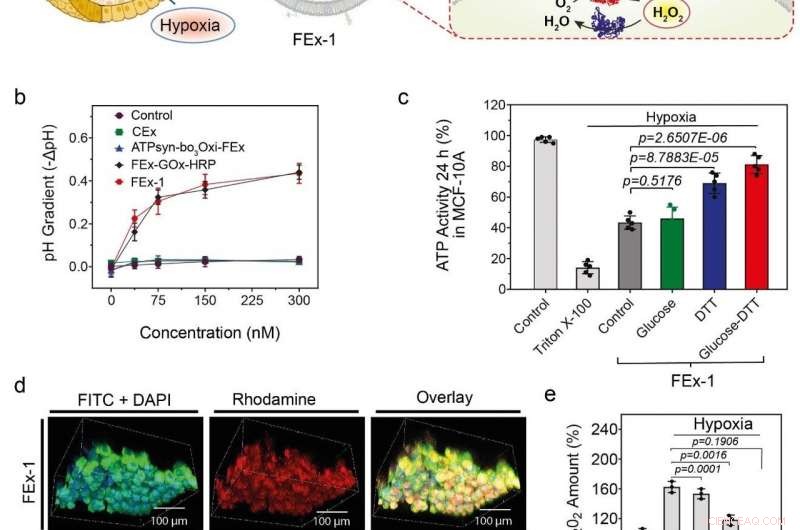
(a) Montering av konstgjorda organeller för energigenerering. ATP-syntas rekonstituerades till CEx-GOx och bo3-oxidas rekonstituerades till CEx-HRP. De två CEx var sammansmälta och kunde penetrera djupt in i sfäroider. (b) Minskning av pH (-ΔpH) vs. glukoskoncentrationer för olika exosomer. Fuserade exosomer visar en högre grad av pH-minskning. (c) Förändringar i ATP-produktion efter FEx-1-upptag under olika förhållanden. (d) Konstgjorda organeller kunde tränga djupt in i sfäroiden. Den översta raden visar FEx-1 (märkt röd med rhodamine B), medan den nedre raden visar fritt HRP-enzym inuti sfäroider. (e) Totala ROS-nivåer minskade när FEx-1 utsattes för glukos och DTT. Kredit:Institutet för grundvetenskap
Nästa, forskarna ville veta exakt hur väl dessa minireaktorer kan tas upp och internaliseras av cellerna. Cellerna som härrörde från mänskliga bröstvävnader matades med sammansmälta exosome nanoreaktorer, och deras internalisering under de följande 48 timmarna observerades med användning av olika markörer och ett konfokalt laserskanningsmikroskop (CLSM). Det visade sig att celler kunde ta upp dessa anpassade exosomer främst genom endocytos, tillsammans med flera andra mekanismer. De testade vidare GOx-HRP två enzymsystem i cellerna, och det visade sig att de sammansmälta exosomerna framgångsrikt kunde tillverka fluorescerande produkter även när de var inne i cellerna.
Beväpnad med denna kunskap, teamet försökte skapa funktionella artificiella mitokondrier som kan producera energi inuti cellerna. För att uppnå detta, ATP-syntas och bo 3 oxidas rekonstituerades till de tidigare exosomer som innehöll GOx och HRP, respektive. Dessa exosomer fusionerades i sin tur för att skapa nanoreaktorer som kan producera ATP med glukos och ditiotreitol (DTT). Det visade sig att de sammansmälta exosomerna kunde penetrera djupt in i kärndelen av en fast sfäroidvävnad och producera ATP i dess hypoxiska miljö. Aktiviteterna hos dessa enkla organeller åtföljdes av markant minskning av generering av reaktiva syrearter (ROS). I kontrast, fria enzymer kunde inte tränga in i dessa tätt packade sfäroider av celler.
"Tagen tillsammans, våra resultat belyser potentialen hos dessa exosomer som nanoreaktorer för att reglera den metaboliska aktiviteten hos celler inuti sfäroider, och för att försvaga cellskador på grund av hypoxi, " noterar CHO Yoon-Kyoung, motsvarande författare till studien. Förhoppningen är att ytterligare forskning om sådana artificiella organeller kommer att presentera ett nytt paradigm inom olika områden som sjukdomsdiagnostik och behandling, bioteknik, medicin, och miljön.