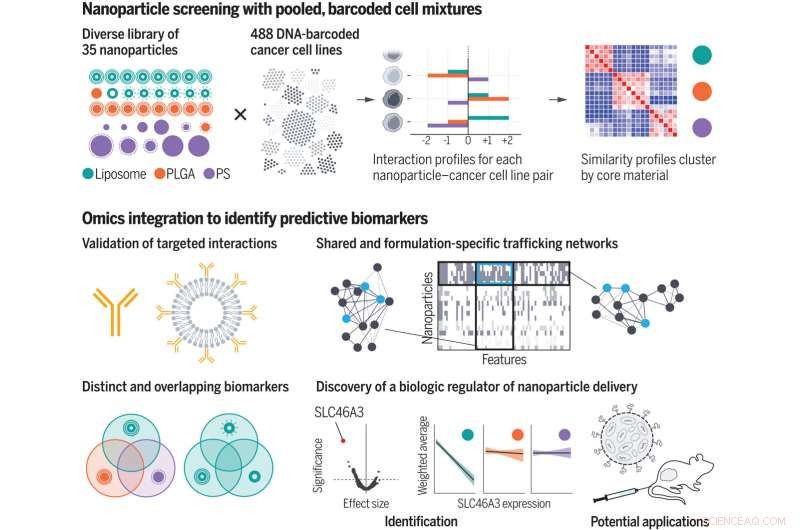
Med hjälp av ett kurerat nanopartikelbibliotek screenade forskarna nanopartikel-cell-interaktionsprofiler för hundratals cancerceller samtidigt. Genom att införliva omics-anteckningar identifierade de biologiska egenskaper, eller biomarkörer, som förmedlar nanopartikelleverans till celler. De skapade traffickingnätverk och upptäckte en biologisk regulator för lipidbaserad leverans av nanopartiklar. PLGA, polylaktid-samglykolid; PS, polystyren. Kredit:Natalie Boehnke et al, Science (2022). DOI:10.1126/science.abm5551
Att använda nanopartiklar för att leverera cancerläkemedel erbjuder ett sätt att slå tumörer med stora doser av läkemedel samtidigt som man undviker de skadliga biverkningar som ofta kommer med kemoterapi. Men hittills har bara en handfull nanopartikelbaserade cancerläkemedel godkänts av FDA.
En ny studie från MIT och Broad Institute of MIT och Harvard-forskare kan hjälpa till att övervinna några av hindren för utvecklingen av nanopartikelbaserade läkemedel. Teamets analys av interaktionerna mellan 35 olika typer av nanopartiklar och nästan 500 typer av cancerceller avslöjade tusentals biologiska egenskaper som påverkar huruvida dessa celler tar upp olika typer av nanopartiklar.
Resultaten kan hjälpa forskare att bättre skräddarsy sina läkemedelsleveranspartiklar till specifika typer av cancer, eller designa nya partiklar som drar fördel av de biologiska egenskaperna hos särskilda typer av cancerceller.
"Vi är glada över våra fynd eftersom det egentligen bara är början - vi kan använda detta tillvägagångssätt för att kartlägga vilka typer av nanopartiklar som är bäst för att rikta in sig på vissa celltyper, från cancer till immunceller och andra typer av friska och sjuka organceller. Vi lär oss hur ytkemi och andra materialegenskaper spelar en roll vid målinriktning", säger Paula Hammond, professor vid MIT Institute, chef för Institutionen för kemiteknik och medlem av MIT:s Koch Institute for Integrative Cancer Research.
Hammond är seniorförfattare till den nya studien, som visas i Science . Tidningens huvudförfattare är Natalie Boehnke, en MIT postdoc som snart kommer att ansluta sig till fakulteten vid University of Minnesota, och Joelle Straehla, Charles W. och Jennifer C. Johnson Clinical Investigator vid Koch Institute, en instruktör vid Harvard Medical School, och en pediatrisk onkolog vid Dana-Farber Cancer Institute.
Cell-partikel-interaktioner
Hammonds labb har tidigare utvecklat många typer av nanopartiklar som kan användas för att leverera läkemedel till celler. Studier i hennes labb och andra har visat att olika typer av cancerceller ofta reagerar olika på samma nanopartiklar. Boehnke, som studerade äggstockscancer när hon gick med i Hammonds labb, och Straehla, som studerade hjärncancer, märkte också detta fenomen i sina studier.
Forskarna antog att biologiska skillnader mellan celler kunde driva variationen i deras svar. För att ta reda på vad dessa skillnader kan vara, bestämde de sig för att genomföra en storskalig studie där de kunde titta på ett stort antal olika celler som interagerar med många typer av nanopartiklar.
Straehla hade nyligen lärt sig om Broad Institutes PRISM-plattform, som utformades för att tillåta forskare att snabbt screena tusentals läkemedel på hundratals olika cancertyper samtidigt. Med instrumentellt samarbete från Angela Koehler, en MIT-docent i biologisk teknik, beslutade teamet att försöka anpassa den plattformen för att screena cell-nanopartikel-interaktioner istället för cell-läkemedelsinteraktioner.
"Med detta tillvägagångssätt kan vi börja fundera på om det finns något med en cells genotypiska signatur som förutsäger hur många nanopartiklar den kommer att ta upp", säger Boehnke.
För sin skärm använde forskarna 488 cancercellinjer från 22 olika ursprungsvävnader. Varje celltyp är "streckkodad" med en unik DNA-sekvens som gör att forskare kan identifiera cellerna senare. För varje celltyp finns även omfattande datauppsättningar tillgängliga med deras genuttrycksprofiler och andra biologiska egenskaper.
På nanopartikelsidan skapade forskarna 35 partiklar, som var och en hade en kärna som bestod av antingen liposomer (partiklar gjorda av många fettmolekyler som kallas lipider), en polymer som kallas PLGA eller en annan polymer som kallas polystyren. Forskarna belade också partiklarna med olika typer av skyddande eller målsökande molekyler, inklusive polymerer som polyetylenglykol, antikroppar och polysackarider. Detta gjorde det möjligt för dem att studera inverkan av både kärnsammansättningen och ytkemin hos partiklarna.
I samarbete med Broad Institute-forskare, inklusive Jennifer Roth, chef för PRISM-labbet, exponerade forskarna pooler med hundratals olika celler för en av 35 olika nanopartiklar. Varje nanopartikel hade en fluorescerande tagg, så forskarna kunde använda en cellsorteringsteknik för att separera cellerna baserat på hur mycket fluorescens de avgav efter en exponering på antingen fyra eller 24 timmar.
Baserat på dessa mätningar tilldelades varje cellinje en poäng som representerade dess affinitet för varje nanopartikel. Forskarna använde sedan maskininlärningsalgoritmer för att analysera dessa poäng tillsammans med alla andra biologiska data som finns tillgängliga för varje cellinje.
Denna analys gav tusentals funktioner, eller biomarkörer, associerade med affinitet för olika typer av nanopartiklar. Många av dessa markörer var gener som kodar för det cellulära maskineriet som behövs för att binda partiklar, föra in dem i en cell eller bearbeta dem. Vissa av dessa gener var redan kända för att vara involverade i nanopartikelhandel, men många andra var nya.
"Vi hittade några markörer som vi förväntade oss, och vi hittade också mycket mer som verkligen har varit outforskade. Vi hoppas att andra människor kan använda denna datauppsättning för att hjälpa till att utöka sin syn på hur nanopartiklar och celler interagerar", säger Straehla.
Partikelupptag
Forskarna valde ut en av biomarkörerna de identifierade, ett protein som heter SLC46A3, för vidare studier. PRISM-skärmen hade visat att höga nivåer av detta protein korrelerade med mycket lågt upptag av lipidbaserade nanopartiklar. När forskarna testade dessa partiklar i musmodeller av melanom fann de samma korrelation. Resultaten tyder på att denna biomarkör skulle kunna användas för att hjälpa läkare att identifiera patienter vars tumörer är mer benägna att svara på nanopartikelbaserade terapier.
Nu försöker forskarna avslöja mekanismen för hur SLC46A3 reglerar nanopartikelupptaget. Om de kunde upptäcka nya sätt att minska cellulära nivåer av detta protein, skulle det kunna bidra till att göra tumörer mer mottagliga för läkemedel som bärs av lipidnanopartiklar. Forskarna arbetar också med att ytterligare utforska några av de andra biomarkörerna de hittat.
Denna screeningmetod skulle också kunna användas för att undersöka många andra typer av nanopartiklar som forskarna inte tittade på i denna studie.
"Himlen är gränsen när det gäller vilka andra oupptäckta biomarkörer som finns där ute som vi bara inte har fångat eftersom vi inte har screenat dem", säger Boehnke. "Förhoppningsvis är det en inspiration för andra att börja titta på sina nanopartikelsystem på ett liknande sätt." + Utforska vidare
Denna berättelse är återpublicerad med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.