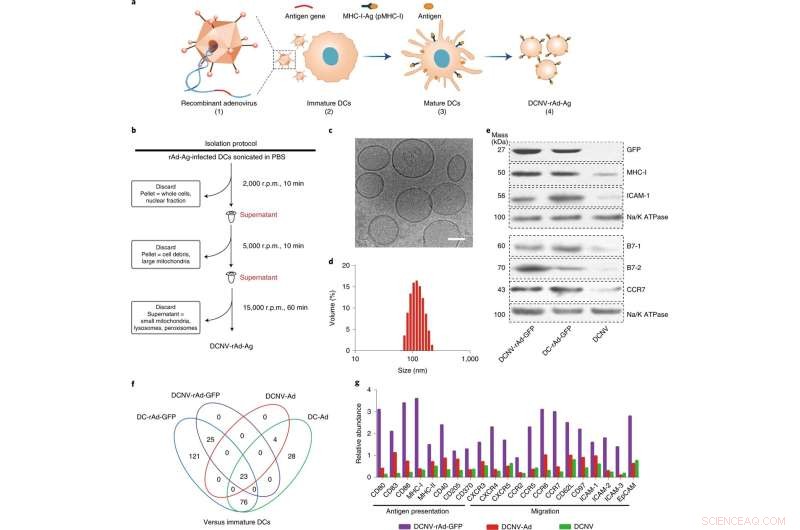
Generering och karakterisering av DCNV-rAd-Ag. a, Generering av DCNVs härledda från adenovirusinfekterade mogna dendritiska celler. (1) Generna av tumörspecifikt antigen modifierades genetiskt in i adenovirusvektorn. (2) Rekombinant adenovirus infekterade de omogna DC2.4-cellerna för att uttrycka det modifierade antigenet på cellytan och stimulera det. (3) Differentiering, mognad och antigenpresentation. (4) Skörd av det inducerade mogna cellmembranet och beredning av DCNV-rAd-Ag. b, Schematisk illustration av genereringen av DCNV-rAd-Ag. c,d, kryo-elektronmikroskopi (c) och dynamisk ljusspridningsanalys (d) visade enhetlig DCNV-rAd-Ag (ungefär 108 nm medeldiameter, polydispersitetsindex =0,14) med en vesikelliknande morfologi. Skalstång, 50 nm. e, Western blotten på membranproteiner från DCNV-rAd-GFP visar ett liknande proteininnehåll på ytan jämfört med föräldracellerna. Paneler c–e visar representativa resultat från två oberoende experiment med liknande resultat. f, Jämförelse av uppreglerade immunsvarsrelaterade proteiner i NV och DC. g, den relativa mängden av antigenpresentation och migrationsrelaterade proteiner på DCNV-rAd-GFP. r.p.m., varv per minut. CCR, CC kemokinreceptor; CXCR, C-X-C kemokinreceptor; EpCAM, epitelcellulär adhesionsmolekyl; ICAM 1, intercellulär adhesionsmolekyl 1; pMHC-I, peptid-major histokompatibilitetskomplex klass I. Kredit:Nature Nanotechnology (2022). DOI:10.1038/s41565-022-01098-0
Eftersom människor över hela världen ser fram emot längre förväntad livslängd, fortsätter maligna cancerformer att utgöra ett hot mot människors hälsa. Utforskningen och utvecklingen av immunterapi syftar till att söka nya genombrott för behandling av solida tumörer.
En framgångsrik etablering av antitumörimmunitet kräver aktivering, expansion och differentiering av antigenspecifika lymfocyter. Denna process beror till stor del på specifika interaktioner mellan olika T-celler och antigenpresenterande celler (APC) i kroppen. Men existerande tumörvacciner, såsom neoantigenvacciner och olika vektorvacciner, är alla beroende av slumpmässiga interaktioner med APC i kroppen. Dessutom kan olämpliga interaktioner leda till att andra immunsvar tystas.
Även om immunkontrollbaserad immunterapi har visat sig ha stor potential, svarar bara en liten del av patienterna fullt ut på denna terapi, och de relevanta molekylära mekanismerna behöver undersökas ytterligare. Denna leveransmetod är dock komplex och ineffektiv.
I en banbrytande utveckling har ett team av forskare under ledning av Narat Muzayyins ordförande professor Chen Xiaoyuan från NUS Yong Loo Lin School of Medicine och professor Liu Gang från Xiamen University formulerat ett nytt vaccin som visade hög effektivitet vid behandling av solida tumörer, vilket uppnådde fullständig eliminering av solida tumörer och inducerar långvarigt immunminne. Detta förhindrar återfall av tumörtillväxt som patienten ursprungligen uppvisade och ger immunitet mot liknande tumörtyper. Detta bevisades genom tillämpningen av detta vaccin på melanomtumörmodeller. Deras resultat publiceras i Nature Nanotechnology .
Teamet kunde konstruera ett dendritisk cell (en typ av APC) membran som användes för att naturligt stimulera immunsystemet och aktivera multidimensionell antitumörimmunitet. Detta gjordes genom en antigen-självpresentation och immunsuppression omvänd nanovesikelvaccinplattform, vilket fick teamet att mynta dess namn, ASPIRE.
ASPIRE-vaccinsystemet kan snabbt framkalla lämpliga, antigenspecifika immunsvar på ett sätt som traditionella vaccinmetoder inte kunde. Detta sätt för antigenpresentation förbättrar avsevärt effektiviteten av immunaktivering, vilket underlättar detta nya vaccins höga effektivitet jämfört med andra vacciner som för närvarande finns tillgängliga. Dessutom kan vaccinet även aktivera både tidigare oexponerade T-celler och utmattade T-celler, vilket underlättar ASPIREs överlägsna antitumörimmunförmågor.
"Vi är glada över den här plattformsteknologins potential för ytterligare tillämpning i andra sjukdomar också, såsom kronisk virusinfektion, där T-cellsutmattning ofta inträffar under infektion och förhindrar optimal viruskontroll", säger professor Chen. "Närnäst hoppas teamet kunna etablera en standardoperationsprocedur för skalad syntes av vaccinet, med korrekt kvalitetskontroll av membranvesiklarna, för klinisk översättning", tillade han.
Professor Chng Wee Joo, seniorkonsult vid avdelningen för hematologi vid avdelningen för hematologi-onkologi vid National University Cancer Institute, Singapore och myelomspecialist, uttalade sig självständigt om studien:"Fältet cancerimmunterapi erbjuder enormt hopp för cancer. patienter. Det finns dock vissa brister med den nuvarande tekniken. Den nuvarande innovationen från prof Chen och hans kollegor övervinner några av dessa brister och förbättrade effektiviteten och
hållbarheten hos immunsvaret på dessa behandlingar. Detta kommer att ge en betydande framsteg som kommer att ha stor inverkan på patienterna." + Utforska vidare