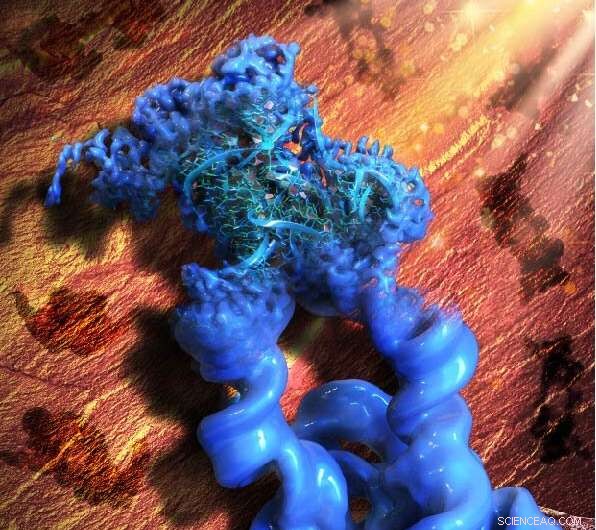
Denna illustration är inspirerad av den paleolitiska klippmålningen i Lascaux-grottan, vilket betyder förkortningen av vår metod, ROCK. Figurativt är mönstren för hällkonsten i bakgrunden (brun) 2D-projektionerna av den konstruerade dimeriska konstruktionen av Tetrahymena-grupp I-intronen, medan huvudobjektet i fronten (blått) är den rekonstruerade 3D-kryo-EM-kartan av dimer, med en monomer i fokus och förfinad till den höga upplösning som gjorde det möjligt för kollaboratörerna att bygga en atommodell av RNA. Kredit:Wyss Institute vid Harvard University
Vi lever i en värld gjord och driven av RNA, det lika viktiga syskonet till den genetiska molekylen DNA. Faktum är att evolutionsbiologer antar att RNA existerade och självreplikerades redan innan uppkomsten av DNA och de proteiner som det kodade för. Snabbspolning framåt till moderna människor:vetenskapen har avslöjat att mindre än 3 % av det mänskliga genomet transkriberas till budbärar-RNA (mRNA)-molekyler som i sin tur översätts till proteiner. Däremot transkriberas 82 % av det till RNA-molekyler med andra funktioner, av vilka många fortfarande är gåtfulla.
För att förstå vad en enskild RNA-molekyl gör måste dess 3D-struktur dechiffreras på nivån av dess ingående atomer och molekylära bindningar. Forskare har rutinmässigt studerat DNA- och proteinmolekyler genom att förvandla dem till regelbundet packade kristaller som kan undersökas med en röntgenstråle (röntgenkristallografi) eller radiovågor (kärnmagnetisk resonans). Dessa tekniker kan dock inte tillämpas på RNA-molekyler med nästan samma effektivitet eftersom deras molekylära sammansättning och strukturella flexibilitet hindrar dem från att lätt bilda kristaller.
Nu, ett forskningssamarbete ledd av Wyss Core Faculty-medlem Peng Yin, Ph.D. vid Wyss Institute for Biologically Inspired Engineering vid Harvard University, och Maofu Liao, Ph.D. vid Harvard Medical School (HMS), har rapporterat ett fundamentalt nytt tillvägagångssätt för strukturell undersökning av RNA-molekyler. ROCK, som det kallas, använder en nanoteknologisk RNA-teknik som gör att den kan sätta ihop flera identiska RNA-molekyler till en välorganiserad struktur, vilket avsevärt minskar flexibiliteten hos enskilda RNA-molekyler och multiplicerar deras molekylvikt. Tillämpad på välkända modell-RNA med olika storlekar och funktioner som riktmärken visade teamet att deras metod möjliggör strukturell analys av de ingående RNA-subenheterna med en teknik som kallas kryo-elektronmikroskopi (cryo-EM). Deras framsteg rapporteras i Naturmetoder .
"ROCK bryter de nuvarande gränserna för RNA-strukturundersökningar och gör det möjligt att låsa upp 3D-strukturer av RNA-molekyler som är svåra eller omöjliga att komma åt med befintliga metoder, och med nära atomär upplösning", säger Yin, som tillsammans med Liao ledde studien . "Vi förväntar oss att detta framsteg kommer att stärka många områden av grundläggande forskning och läkemedelsutveckling, inklusive det växande området för RNA-terapi." Yin är också ledare för Wyss Institutes Molecular Robotics Initiative och professor vid institutionen för systembiologi vid HMS.
Få kontroll över RNA
Yins team vid Wyss Institute har banat väg för olika tillvägagångssätt som gör det möjligt för DNA- och RNA-molekyler att själva montera ihop till stora strukturer baserat på olika principer och krav, inklusive DNA-tegelstenar och DNA-origami. De antog att sådana strategier också skulle kunna användas för att sätta ihop naturligt förekommande RNA-molekyler till högordnade cirkulära komplex där deras frihet att flexa och röra sig är mycket begränsad genom att specifikt koppla dem samman. Många RNA:n viker sig på komplexa men förutsägbara sätt, med små segment som basparar sig med varandra. Resultatet är ofta en stabiliserad "kärna" och "stamöglor" som buktar ut i periferin.
"I vårt tillvägagångssätt installerar vi "kyssslingor" som länkar samman olika perifera stamslingor som tillhör två kopior av ett identiskt RNA på ett sätt som gör att en övergripande stabiliserad ring kan bildas, som innehåller flera kopior av RNA av intresse, säger Di. Liu, Ph.D., en av två förstaförfattare och en postdoktor i Yins grupp. "Vi spekulerade i att dessa ringar av högre ordning kunde analyseras med hög upplösning med cryo-EM, som hade applicerats på RNA-molekyler med första framgång."
Bildstabiliserat RNA
I cryo-EM flash-fryss många enstaka partiklar vid kryogena temperaturer för att förhindra ytterligare rörelser, och visualiseras sedan med ett elektronmikroskop och med hjälp av beräkningsalgoritmer som jämför de olika aspekterna av en partikels 2D-ytprojektioner och rekonstruerar dess 3D-arkitektur . Peng och Liu slog sig ihop med Liao och hans tidigare doktorand François Thélot, Ph.D., den andra medförfattaren till studien. Liao med sin grupp har gjort viktiga bidrag till det snabbt framskridande kryo-EM-fältet och den experimentella och beräkningsmässiga analysen av enskilda partiklar som bildas av specifika proteiner.
"Cryo-EM har stora fördelar jämfört med traditionella metoder när det gäller att se högupplösta detaljer av biologiska molekyler inklusive proteiner, DNA och RNA, men den lilla storleken och rörliga tendensen hos de flesta RNA förhindrar framgångsrik bestämning av RNA-strukturer. Vår nya metod för att montera RNA-multimerer löser dessa två problem samtidigt, genom att öka storleken på RNA och minska dess rörelse, säger Liao, som också är docent i cellbiologi vid HMS. "Vårt tillvägagångssätt har öppnat dörren till snabb strukturbestämning av många RNA genom cryo-EM." Integrationen av RNA-nanoteknologi och cryo-EM-metoder fick teamet att döpa sin metod till "RNA-oligomeriseringsaktiverad cryo-EM via installation av kyssslingor" (ROCK).
För att ge proof-of-principe för ROCK fokuserade teamet på ett stort intron-RNA från Tetrahymena, en encellig organism, och ett litet intron-RNA från Azoarcus, en kvävefixerande bakterie, samt den så kallade FMN-riboswitchen . Intron-RNA är icke-kodande RNA-sekvenser utspridda i sekvenserna av nyligen transkriberade RNA och måste "skarvas" ut för att det mogna RNA:t ska kunna genereras. FMN-riboswitchen finns i bakteriellt RNA som är involverat i biosyntesen av flavinmetaboliter härrörande från vitamin B2. När den binder en av dem, flavinmononukleotid (FMN), ändrar den sin 3D-konformation och undertrycker syntesen av dess moder-RNA.
"Sammansättningen av Tetrahymena grupp I-intron till en ringliknande struktur gjorde proverna mer homogena och möjliggjorde användningen av beräkningsverktyg som utnyttjade symmetrin i den sammansatta strukturen. Även om vår datauppsättning är relativt blygsam i storlek, tillät ROCKs medfödda fördelar oss att lösa strukturen med en aldrig tidigare skådad upplösning", sa Thélot. "RNA:s kärna är upplöst vid 2,85 Å [en Ångström är en tio miljarder (US) av en meter och det föredragna måttet som används av strukturbiologer], vilket avslöjar detaljerade egenskaper hos nukleotidbaserna och sockerryggraden. Jag tror inte att vi kunde ha kommit dit utan ROCK - eller åtminstone inte utan betydligt mer resurser."
Cryo-EM kan också fånga molekyler i olika tillstånd om de till exempel ändrar sin 3D-konformation som en del av sin funktion. Genom att applicera ROCK på Azoarcus intron-RNA och FMN-riboswitchen, lyckades teamet identifiera de olika konformationerna som Azoarcus-intronen övergår genom under sin självskarvningsprocess, och att avslöja den relativa konformationsstyvheten hos FMN-riboswitchens ligandbindningsställe. .
"Denna studie av Peng Yin och hans medarbetare visar elegant hur RNA-nanoteknik kan fungera som en accelerator för att främja andra discipliner. Att kunna visualisera och förstå strukturerna hos många naturligt förekommande RNA-molekyler kan ha en enorm inverkan på vår förståelse av många biologiska och patologiska processer över olika celltyper, vävnader och organismer, och möjliggör till och med nya metoder för läkemedelsutveckling", säger Wyss grundare Donald Ingber, M.D., Ph.D. + Utforska vidare