
3D nanoendoskopi-AFM-teknik. (A) Schematisk 3D-nanoendoskopi-AFM-metoden, där nanosonden upprepade gånger introduceras inuti cellen på olika positioner i det önskade området. (B) FIB-tillverkad nanosond som används i 3D nanoendoskopi-AFM mätningar. (C och D) Typiska F-z-kurvor som erhålls genom att penetrera en cell, där en abrupt minskning av fribärande avböjning avbildas som en topp när nanosonden penetrerar det externa cellmembranet (C), uppträder som en annan topp om nanosonden tränger igenom kärnmembranet (D). (G) 3D nanoendoskopi-AFM-cellkarta över hela HeLa-cellvolymen (40 × 40 × 6 μm3) innesluten i den röda fyrkanten i (E), där cellmembranet, kärnan och cytoplasmaregionerna kan urskiljas i tvärsnittet visas i (H). (I) 3D nanoendoskopi-AFM-bild av en HeLa-cellvolym (10 × 10 × 6 μm3) innesluten i den röda fyrkanten i (F), där interna granulära strukturer tydligt kan kännas igen. Kredit:Science Advances , 10.1126/sciadv.abj4990
Atomic force microscopy (AFM) erbjuder en metod för etikettfri avbildning av biomolekylär dynamik i nanoskala för att lösa biologiska frågor som inte kan lösas via andra bioavbildningsmetoder inklusive fluorescens och svepelektronmikroskopi. Eftersom sådana avbildningsmetoder endast är möjliga för biologiska system extraherade från celler eller rekonstruerade på fasta substrat, förblir nanodynamik inom levande celler i stort sett otillgänglig med befintliga bioavbildningsmetoder. I en ny rapport som nu publicerats i Science Advances , Marcos Penedo och ett forskarlag inom Nanolife Science and biotechnology vid Kanazawa University i Japan, övervann gränserna för bioavbildning genom att använda nanoendoskopi-AFM. Under processen förde de in en nålliknande sond i en levande cell för att presentera aktinfiber, tredimensionella (3D) kartor och 2D nanodynamik av membranets inre ställning med oupptäckbara förändringar i cellviabilitet. Till skillnad från tidigare AFM-metoder fick nanosonden direkt åtkomst till de intracellulära målkomponenterna och utforskade funktionerna hos AFM, inklusive högupplöst bildbehandling, nanomekanisk kartläggning och molekylär igenkänning för att utöka det observerbara utbudet av intracellulära strukturer i levande celler.
Bioavbildning av intracellulär dynamik
Molekylär skala dynamik hos intracellulära komponenter ger insikt i de grundläggande mekanismerna för cellfunktioner och sjukdom. Direkta avbildningsmetoder för sådan nanodynamik i levande celler är dock utmanande. Till exempel, medan elektronmikroskopi är användbart för att avbilda nanostrukturer av frusna celler i vakuum, är de oförmögna att avbilda nanodynamik i levande celler under fysiologiska miljöer, förutom som statiska ögonblicksbilder av fasta konformationer. På samma sätt, medan fluorescensmikroskopi via fluorescensmärkning ger en kraftfull metod för att visualisera dynamiken hos proteiner och organeller i levande celler, begränsas de av en oförmåga att effektivt avbilda i nanoskala. Det finns därför höga krav på en märkningsfri intracellulär avbildningsmetod i flytande miljöer. Atomkraftsmikroskopi (AFM) är en potentiell kandidat för rollen med kapacitet att avbilda på subnanometerskala för att visualisera nanodynamik hos lipider, proteiner och DNA utan märkning. Sådana bilder är dock inte representativa för biologiska system som ett resultat av extraktion från en cell eller rekonstruktion på ett fast substrat in vitro. I detta arbete har därför Penedo et al. föreslog en AFM-baserad avbildningsmetod känd som nanoendoskopi-AFM för att observera nanodynamik inuti levande celler utan att märka eller bryta isär dem.
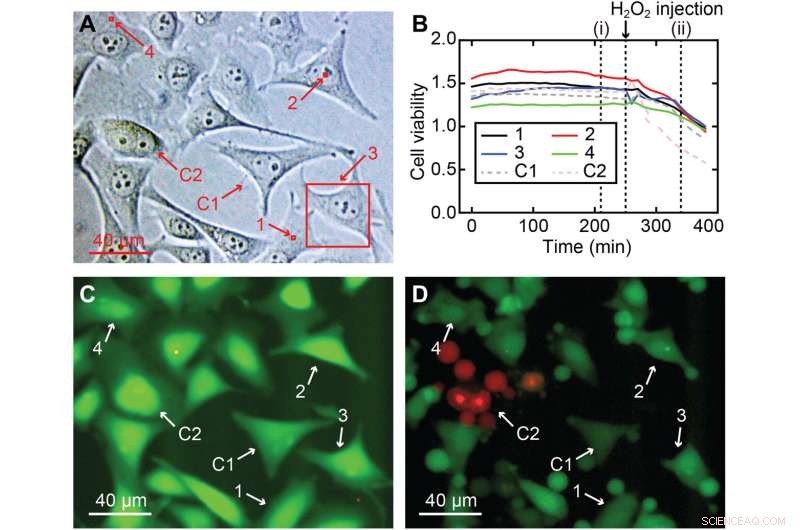
Cellviabilitet av 3D nanoendoskopi-AFM mätningar. (A) Olika uppmätta områden utförda i en HeLa-cellkultur för cellviabilitetstestet, inklusive kärn- och cellperiferiregioner:(1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3, och (4) 2 × 2 × 7 μm3, markerad i röda rutor; två celler användes som kontroll, Cl och C2. (B) Cellviabilitetsförhållanden över tid för de fyra avbildade cellerna (1 till 4) och för de två cellerna som används som en kontroll (C1 och C2), vilket visar att alla celler (avbildade och kontroll) hade en liknande intensitet för platta cellviabilitet förhållandet och bekräftar att cellerna inte var särskilt skadade. (C) Exempel på en fluorescensbild efter 210 min motsvarande (i) i (B), där den starka gröna färgen betyder en normal esterasaktivitet som förväntas för en levande cell. För att kontrollera analysens giltighet tillsattes H2O2 efter 260 minuter till mediet för att döda cellerna, vilket resulterade i en minskning av cellviabilitetsförhållandena för alla celler, en tydlig indikation på att cellerna dör. (D) Fluorescensögonblicksbild som motsvarar tiden (ii) i (B), där tecken på skada är tydligt synliga i alla celler, av vilka de flesta redan lidit av krympning eller apoptos. Kredit:Science Advances , 10.1126/sciadv.abj4990
Nanoendoskopi-AFM-experiment
Under experimenten, ungefär som en endoskopisk kamera, satte forskarna in en lång nålliknande nanosond inuti en levande cell för att utföra 2D- och 3D-AFM-avbildning. Teamet visade hur nanoendoskopi-AFM gav en unik fördel för etikettfri intracellulär avbildning av levande celler i nanoskala. Metoden ger en kraftfull väg för att observera hittills outforskade fenomen i biologiska system. Penedo et al. upprepade gånger introducerade nanosonden inuti cellen vid olika positioner av det önskade området via kraft kontra avstånd kurvmätningar. För att avbilda hela cellen måste nanosonden vara tillräckligt lång för att helt penetrera cellen tills den nådde substratet, och med diametrar under 200 nm för att minimera cellskador, samtidigt som membranpenetrationen underlättades. Teamet använde en kommersiell tetraedrisk kiselspets som en nanosond, som de fräste med fokuserad jonstrålefräsning till önskade dimensioner. Teamet använde sedan nanosonderna i olika områden i en HeLa-cell. De förvärvade en 3D nanoendoskopi-AFM-bild av en hel cell under experimenten och identifierade kärnan i HeLa-cellen från resten av cellen. Ytterligare mätningar indikerade också de inre granulära strukturerna. För att minimera cellskador under penetration, Penedo et al. minskat penetrationskraften och intryckningslängden så mycket som möjligt. De genomförde också cellviabilitetsexperiment för att bekräfta att 3D nanoendoskopi-AFM inte ledde till allvarlig cellskada vid användning av nanosonder med diametrar under 200 nm. Med hjälp av 3D nanoendoskopi-AFM, underlättade de avbildning av det inre cytoskelettet i levande celler för att observera 3D-organisation av de ostödda fibrerna. Teamet slog också samman intracellulära bilder från 3D-nanoendoskopi-AFM och konfokalmikroskopi.

Kombination av konfokal avbildning och 3D nanoendoskopi-AFM. (A) Konfokal fluorescensbild där de färgade aktinfilamenten är synliga. (B) Den förstorade bilden som erhålls vid området som indikeras av den röda fyrkanten i (A). (C och D) 3D nanoendoskopi-AFM-kartor över cytoskelettaktinfibrer erhållna vid området markerat av den röda fyrkanten i (B), där de Z vertikala positionerna för de olika aktinfilamenten (röda pilar) och de övre och nedre cellmembranen löses samtidigt. Den halvtransparenta bilden som visas i den röda fyrkanten i (B) motsvarar 2D-projektionen av 3D-kartorna som visas i (C) och (D). Kredit:Science Advances , 10.1126/sciadv.abj4990
2D nanoendoskopi-AFM
Möjligheten att sätta in en lång nanosond i en cell många gånger samtidigt som cellviabiliteten bibehålls innebar potentialen att lokalisera sondens spets i en levande cell för att utföra lokala 2D/3D AFM-mätningar utan betydande skada. Nanosonden kan sättas in i cellen för att mäta den cytoplasmatiska sidan av cellmembranet via amplitudmoduleringsläge AFM. Nanosonderna måste vara tillräckligt långa för att helt penetrera cellen och nå dess botten, samtidigt som de var tillräckligt tunna för att minska cellskadorna. För att åstadkomma detta i praktiken har Penedo et al. utvecklat nanosonder gjorda av amorft kol med hjälp av elektronstråleavsättning och mätte amplitudberoendet på avståndet, för att bestämma cellens integritet. De utförde 2D nanoendoskopi-AFM-experiment med användning av en fibroblastcell för att illustrera den retikulära strukturen av det inre cellmembranet och observerade cellarkitekturen för att studera inre dynamik hos cellstrukturer. Arbetet lyfte fram möjligheten att använda 2D nanoendoskopi-AFM för att studera nanodynamiken hos interna strukturer i levande celler under fysiologiska miljöer.

2D nanoendoskopi-AFM-teknik. (A) Illustration av 2D-nanoendoskopi-AFM-metoden, där nanosonden sätts in i cellen för att mäta den cytoplasmatiska sidan av cellmembranet med amplitudmoduleringsläge AFM. (B) Exempel på en EBD-tillverkad nanosond som används i 2D nanoendoskopi-AFM, där längden på nålen ska vara tillräckligt lång för att helt penetrera cellen och nå dess bottendel och tunn nog för att minska cellskadan. (C) Registrerad kraft (överst) och amplitud (botten) kontra avståndskurvor för att exakt lokalisera de övre och nedre cellmembranen:Den vertikala kraften är noll när nanosonden är långt borta, ökar så snart nanosonden vidrör det övre cellmembranet; efteråt presenterar den en platå som motsvarar den interna cytoplasmatiska domänen tills kurvan ökar kraftigt igen när nanosonden når bottencellmembranet. Amplitudinställningspunkten för spets-provavståndsregleringen måste vara tillräckligt låg för att säkerställa att spetsen knackar mot cellens bottenyta. (F) Konsekutiv 2D nanoendoskopi-AFM 1 μm × 1 μm bilder utförda på en BALB/3T3 fibroblast på regionen markerad av den röda pricken som avbildas i (D), som visar den retikulära strukturen på den inre ytan av cellmembranet som bildar dess byggnadsställningar och även membranfluktuationerna under mätningarna. (G) Zoomat område av bilderna som visas i (F), ritar ett avsnitt mellan punkterna A och B (E), där två utsprång separerade med 25 nm är tydligt upplösta i bilden. Kredit:Science Advances , 10.1126/sciadv.abj4990
Outlook
På detta sätt visade Marcos Penedo och kollegor tillämpningarna av nanoendoskopi-AFM för att mäta cytoplasmatiska inre ytor av cellmembran och tillhörande byggnadsställningar för att förstå 3D-arrangemang av aktinfilament i deras naturliga intracellulära miljö i levande celler. Teamet försökte minimera cellskador genom att använda ultratunna nålliknande nanosonder i experimenten. De föreslagna AFM-metoderna producerade 3D-kartor över interna cellstrukturer utöver 2D-projektioner kombinerade med befintliga fluorescensmetoder som konfokal eller superupplösningsmikroskopi. Metoden kommer att belysa cellmaskineri i aktion, in vivo, samtidigt som fysiologiska molekylära motorer exponeras. Metoden kommer också att öppna nya möjligheter att studera intracellulär nanomekanik som spelar en viktig roll i cellulära funktioner. Teamet kan använda metoden för att mäta kärnans styvhet, vidhäftning och avledningsegenskaper för att extrahera biologisk information som lämpar sig för tvärvetenskapliga områden inom cellbiologi och medicin. + Utforska vidare
© 2022 Science X Network