Fig. 1. Forskare har länge försökt att avkoda proteiners komplexa substrukturer. Nu har forskare från Tokyo Tech äntligen belyst denna front med undersökningen av konstruerad proteinsjälvsammansättning med hjälp av proteinnålar. Kredit:Takafumi Ueno från Tokyo Institute of Technology
Proteinsammansättning är avgörande för bildandet av ordnade biologiska strukturer, men tänk dig ingenjörskonst. Det är precis vad forskare vid Tokyo Tech nu har åstadkommit med proteinnålar. Genom att reglera spets-till-spets-interaktionerna för dessa nålar, tillät de deras självmontering i gitterstrukturer, ordnade monomera tillstånd och fibersammansättningar, vilket banade väg för den kontrollerade konstruktionen av fler av sådana proteinarkitekturer.
Proteiner är de grundläggande byggstenarna i våra kroppar. Deras molekylära och makroskopiska strukturer är dock komplexa och varierande, med flera vikningsmönster och understrukturer. Forskare har försökt avkoda dessa strukturer under en tid, och många framsteg har gjorts tack vare fluorescensmikroskopi (FM), atomkraftsmikroskopi (AFM) och höghastighets-AFM (HS-AFM). De har dock inte direkt kunnat observera de dynamiska rörelserna hos proteiner under montering. Detta beror främst på den invecklade strukturen hos proteiner, som är för små för att kunna mätas med befintliga tekniker.
Ett samarbetande team av forskare från Tokyo Institute of Technology (Tokyo Tech), Kyushu University, Nagoya University och National Institutes of Natural Sciences har nu utvecklat en specialiserad anisotropisk proteinnål (PN) för att hjälpa till att bestämma sammansättningen av liknande anisotropa proteiner, vilket ger oss ledtrådar om deras mikrostruktur och montering.
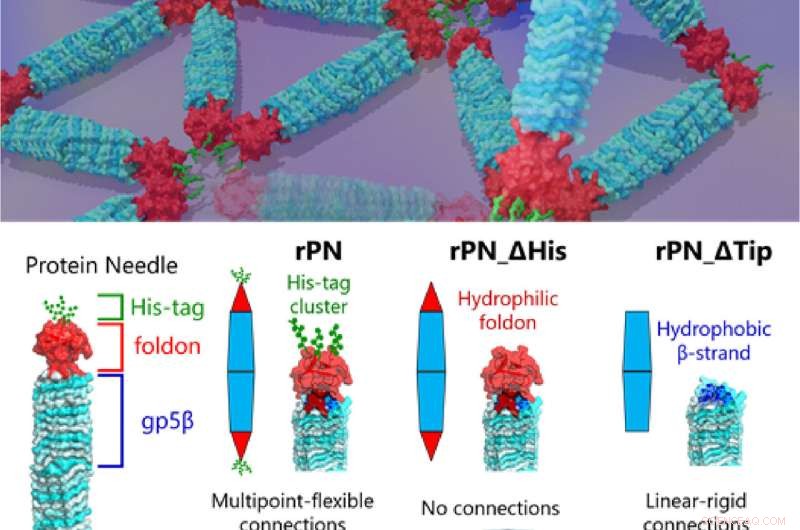
Prof. Takafumi Ueno från Tokyo Tech, som ledde studien, förklarar premissen för deras arbete, "Vårt PN är ett nålformat protein som består av den stela kroppen (β-helix), den terminala hatten (vikningen) och en bindning motiv (hexa-histidin-tagg, His-tag). Genom att modifiera dessa PN:n genom att ta bort His-tag-motivet och vikningslocket kan vi producera tre olika typer av PN:er. Detta gjorde det möjligt för oss att reglera och observera olika monteringsmönster och hur de förändras , vilket ger oss ledtrådar till mekaniken för olika protein-protein-interaktioner som vi hittar i naturen." Resultaten av denna studie publicerades i tidskriften Small.
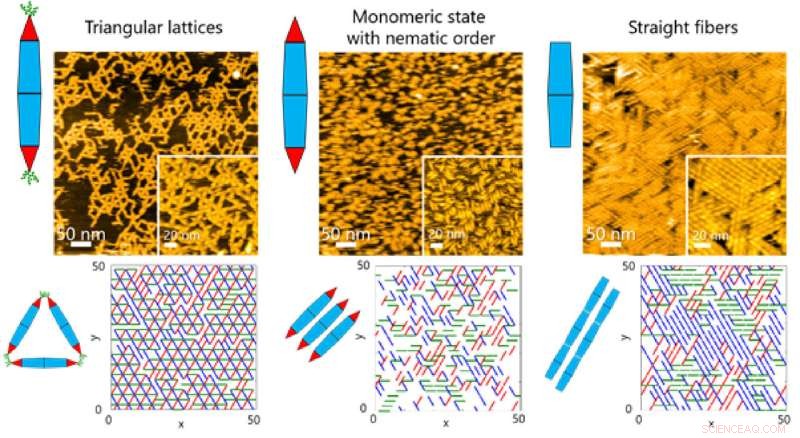
Fig. 2. Grundläggande proteinkedjor genomgår ofta dynamisk självmontering för att bilda komplexa supramolekylära strukturer. Forskare vid Tokyo Tech har nu lyckats utforska sammansättningsdynamiken med hjälp av konstruerade proteinnålar. Kredit:Takafumi Ueno från Tokyo Institute of Technology
I lösning bildar PNs spontant en mycket stabil struktur med en längd på cirka 20 nm och en bredd på cirka 3,5 nm, tillräckligt liten för att spåra rotationsrörelsen hos enskilda molekyler men ändå mekaniskt stark.
På ytor observerade teamet olika sorters ordnade strukturer när PN:erna monterades själv. Dessa strukturer sträckte sig från triangulära gitter och monomera tillstånd med nematisk ordning (endimensionell orientering) till fibersammansättningar (Figur 1).
Detta i sin tur gjorde det möjligt för teamet att undersöka de dynamiska processerna som är involverade i proteinsammansättning genom en kombination av HS-AFM och simuleringar (Figur 2). Resultaten avslöjade att bildningen av den triangulära gitterstrukturen styrdes av PNs dynamiska rörelser, som bidrar till att bilda ordnade gitter (Figur 3).
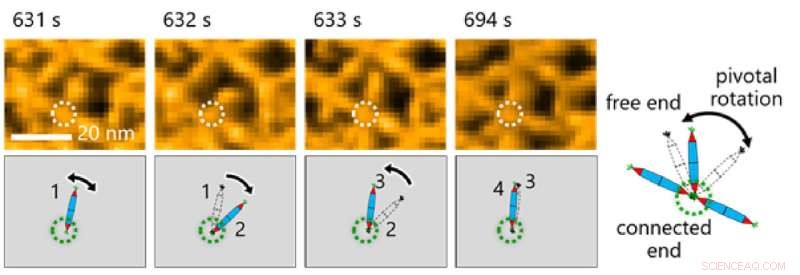
Fig. 3. Att observera PNs molekylära rörelse var avgörande för att göra observationer i denna studie. Här noterade forskare pivotal rotation kring His-tag-interaktionen mellan proteinnålar. Kredit:Takafumi Ueno från Tokyo Institute of Technology
Dessa fynd har upphetsat forskarna, som överväger dess potentiella konsekvenser. "Dessa molekyler spelar en så avgörande roll i biologiska system att förståelse av deras struktur skulle främja fältet avsevärt. Till exempel kan vi använda detta för att lägga grunden för att konstruera supramolekylära strukturer genom att designa de dynamiska kollektiva rörelserna av proteiner. Detta koncept kan leda till konstruktion av biokompatibla arkmaterial, riktade läkemedelstransporter och till och med proteinbaserade nanorobotar", säger prof. Ueno. + Utforska vidare