Forskare skapade en transistorliknande "logisk grind", som är en typ av beräkningsoperation där flera ingångar styr en utdata och bäddade in den i ett protein. De fann att de inte bara snabbt kunde aktivera proteinet med hjälp av ljus och läkemedlet rapamycin, utan också att denna aktivering resulterade i att cellerna genomgick interna förändringar som förbättrade deras vidhäftningsförmåga, vilket i slutändan minskade deras motilitet. Kredit:Penn State
Skapandet av datorer i nanoskala för användning i precisionssjukvård har länge varit en dröm för många forskare och vårdgivare. Nu har forskare vid Penn State för första gången tagit fram ett nanodatamedel som kan kontrollera funktionen hos ett visst protein som är involverat i cellrörelser och cancermetastaser. Forskningen banar väg för konstruktion av komplexa datorer i nanoskala för förebyggande och behandling av cancer och andra sjukdomar.
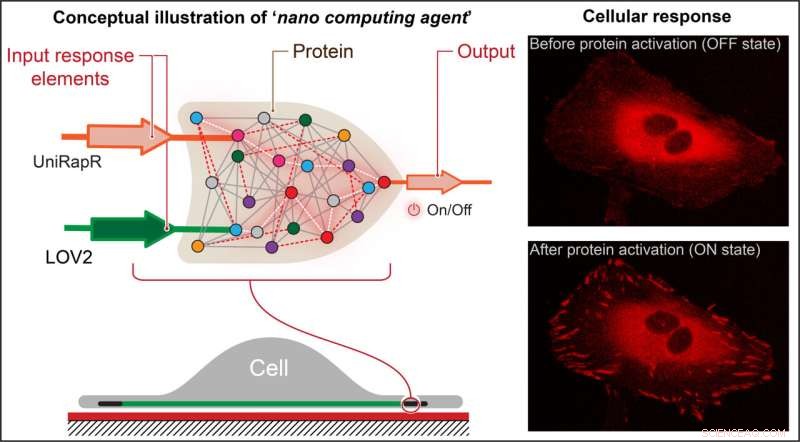
Nikolay Dokholyan, G. Thomas Passananti-professor, Penn State College of Medicine, och hans kollegor – inklusive Yashavantha Vishweshwaraiah, postdoktor i farmakologi, Penn State – skapade en transistorliknande 'logic gate', som är en typ av beräkningsoperation där flera ingångar styr en utgång.
"Vår logiska gate är bara början på vad man kan kalla cellulär datoranvändning," sa han, "men det är en viktig milstolpe eftersom den visar förmågan att bädda in villkorade operationer i ett protein och kontrollera dess funktion, säger Dokholyan. "Det kommer att tillåter oss att få en djupare förståelse av mänsklig biologi och sjukdomar och introducerar möjligheter för utveckling av precisionsterapi."
Teamets logiska grind bestod av två sensordomäner utformade för att svara på två ingångar – ljus och läkemedlet rapamycin. Teamet riktade in sig på proteinfocal adhesion kinas (FAK) eftersom det är involverat i cellvidhäftning och rörelse, vilket är de första stegen i utvecklingen av metastaserande cancer.
"Först introducerade vi en rapamycinkänslig domän, kallad uniRapr, som labbet tidigare hade designat och studerat, i genen som kodar för FAK", säger Vishweshwaraiah. "Närnäst introducerade vi domänen, LOV2, som är känslig för ljus. När vi väl optimerat båda domänerna kombinerade vi dem till en slutlig logic-gate design."
Teamet infogade den modifierade genen i HeLa-cancerceller och, med hjälp av konfokalmikroskopi, observerade cellerna in vitro. De studerade effekterna av var och en av ingångarna separat, såväl som de kombinerade effekterna av ingångarna, på cellernas beteende.
De upptäckte att de inte bara snabbt kunde aktivera FAK med ljus och rapamycin, utan också att denna aktivering resulterade i att cellerna genomgick inre förändringar som förbättrade deras vidhäftningsförmåga, vilket i slutändan minskade deras rörlighet.
Deras resultat publicerade idag (16 november) i tidskriften Nature Communications .
"Vi visar för första gången att vi kan bygga ett fungerande nanodatormedel i levande celler som kan kontrollera cellbeteende", säger Vishweshwaraiah. "Vi upptäckte också några intressanta egenskaper hos FAK-proteinet, som de förändringar det utlöser i celler när det aktiveras."
Dokholyan noterade att teamet hoppas på att så småningom testa dessa nanodatormedel in vivo i levande organismer.
Andra Penn State författare på tidningen inkluderar Jiaxing Chen, doktorand; Venkat R. Chirasani, postdoktor; och Erdem D. Tabdanov, biträdande professor i farmakologi. + Utforska vidare