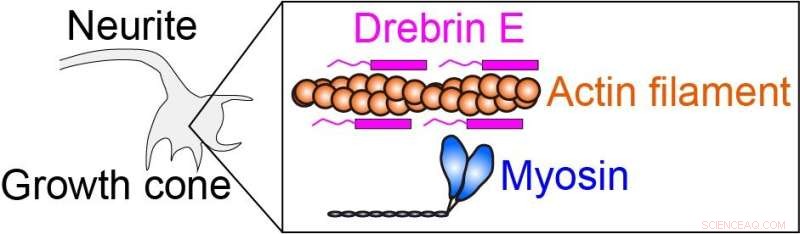
Intracellulär kraft produceras av myosin som interagerar med aktinfilament (proteinfilament). Drebrin E kan hämma aktin-myosin-interaktionen och därmed reglera den intracellulära kraften. Det har varit känt att koncentrationen av drebrin E minskar under djurens utveckling. En korrelation mellan drebrinkoncentrationen och aktin-myosinaktiviteten har dock förblivit oklar, särskilt vid den fysiologiska temperaturen. Kredit:Hiroaki Kubota et al.
En grad celsius kan göra skillnad:ett team av utredare ledda av Osaka University har visat reglering av ett kritiskt proteinkomplex som endast inträffar vid fysiologisk temperatur.
För att studera proteiners funktioner undersöker utredarna renade proteiner in vitro. Sådana experiment är i allmänhet begränsade till temperaturer under fysiologisk temperatur för att förhindra termisk skada på proteinerna. Teamet har övervunnit detta problem genom att tillämpa optiskt kontrollerad uppvärmning med en pulsad infraröd laser. "Med den här metoden kan proteiner värmas upp till 40 grader Celsius utan att proteinerna skadas", säger huvudförfattaren Hiroaki Kubota, "vilket gör det möjligt för oss att undersöka hur proteiner verkar vid sin fysiologiska temperatur."
Utredarna använde denna uppvärmningsmetod för att studera aktomyosinkomplexet. Actomyosin kraftgenerering, som är ett resultat av interaktionen mellan myosinmolekylära motorer och aktinfilament, är en avgörande process som styr cellmotilitet och morfologi. Proteinet drebrin E har visat sig hämma dessa interaktioner, men dess regleringsmekanism är oklar. För att klargöra rollen av drebrin E, tillämpade teamet mikroskopisk uppvärmning på actomyosin i närvaro av drebrin och observerade rörligheten som produceras av actomyosin kraftgenerering över ett område från rumstemperatur till fysiologisk temperatur.
Forskarna fann att hämningen av actomyosin motilitet av drebrin E elimineras omedelbart och reversibelt under uppvärmning, beroende på drebrin E-koncentrationen. När temperaturen ökar, minskar hämningen av actomyosin-motiliteten av drebrin E. Teamet fann också att den minskade hämningen inte enbart orsakas av dissociation av drebrin E från aktin. Istället reglerar bundet drebrin E i samarbete aktomyosinaktivitet troligen genom att förändra aktinstrukturen.
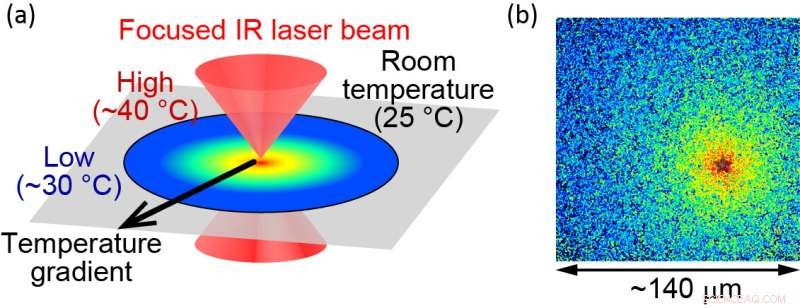
(a) Illustration av den optiskt kontrollerade mikroskopiska uppvärmningsmetoden. (b) Lokaliserad temperatur visualiseras med hjälp av fluorescerande molekyler. Värmekällan är placerad vid "stjärnan", där temperaturen mäts till cirka 40 °C. Synfältets slut är cirka 30 °C. Storleken på synfältet är cirka 140 μm. Kredit:Hiroaki Kubota et al.
Intressant nog, under fysiologisk temperatur, visar actomyosin-rörligheten en gradvis försämring med ökande koncentration av drebrin E. Ändå, vid 36,5 grader Celsius till 37,5 grader Celsius, förändras beteendet, och drebrin E uppvisar ett hämningsbeteende av switchtyp. Motiliteten är opåverkad av drebrin E-koncentrationen tills en tröskel nås, vilket omedelbart resulterar i hämning. Deras resultat tyder på att tröskelkoncentrationen liknar tidigare rapporterade fysiologiska drebrin E-koncentrationer.
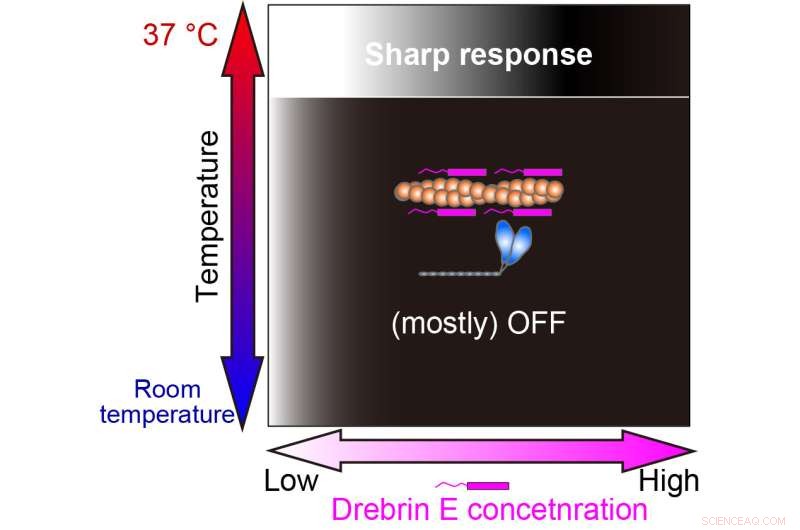
Vår studie visade att regleringen av aktin-myosin-interaktion av drebrin E är effektiv endast vid den fysiologiska temperaturen (37 ° C). Den vit-svarta graderingen representerar kraftproduktionen På (vit) och Av (svart). Kredit:Hiroaki Kubota et al.
Denna temperaturberoende reglering av drebrin E är anmärkningsvärd och har många konsekvenser för framtida studier. "Dessa resultat tyder på vikten av att gravida däggdjur upprätthåller lämplig kroppstemperatur för att säkerställa exakt utveckling av ett embryo", säger Madoka Suzuki, senior författare. Dessutom, genom att få en exakt förståelse av mekanismerna för cellulära temperaturavkännande maskiner, kanske vi kan förnya utvecklingen av konstgjorda temperatursensorer i nanoskala.
Artikeln "Microscopic temperature control reveals cooperative Regulation of actin–myosin interaction by drebrin E" publicerades i Nano Letters . + Utforska vidare