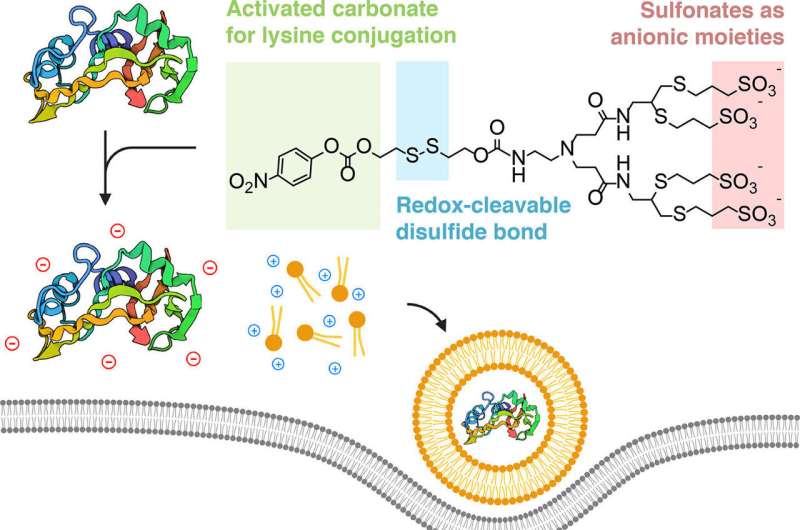
Ett tvärvetenskapligt samarbete har utformat ett sätt att "dölja" proteiner så att de kan fångas upp av lipidnanopartiklar, som är besläktade med små fettbubblor. Dessa bubblor är tillräckligt små för att smyga in sin dolda last in i levande celler, där proteinerna lösgörs och utövar sin terapeutiska effekt.
Den generaliserbara tekniken kan leda till att tusentals kommersiella proteinprodukter, inklusive antikroppar, återanvänds för biologisk forskning och terapeutiska tillämpningar.
Gruppens artikel, "Bioreversible Anionic Cloaking Enables Intracellular Protein Delivery with Jonizable Lipid Nanopartiklar", publicerad 14 maj i ACS Central Science . Huvudförfattare är doktoranden Azmain Alamgir, som arbetar i labben hos tidningens medförfattare, Chris Alabi, docent i kemi- och biomolekylär ingenjörsteknik i Cornell Engineering, och Matt DeLisa, William L. Lewis professor i teknik och direktör. från Cornell Institute of Biotechnology.
Projektet började med ett unikt mål:att kombinera DeLisa-gruppens expertis i att designa proteinbaserad terapi med Alabi-labbets fokus på intracellulär leverans av biologiska läkemedel.
För att vissa läkemedel ska påverka en cells biologi och i slutändan behandla sjukdomar, måste de komma in i cellen och nå ett specifikt utrymme. Detta liknar att laga ett trasigt rör i ett hem:rörmokaren måste komma åt ett visst rum för att reparera läckan.
Proteinbaserade terapier har många fördelar - de kan ha mer specifika effekter, med lägre toxicitet och minskat immunsvar - men enkel leverans är inte en av dem. Proteiner är stora och besvärliga och diffunderar inte fritt in i cellerna lika lätt som små molekyler gör. Det är en anledning till att små molekyler är den dominerande källan till läkemedel inom läkemedelsindustrin:de kan lätt diffundera in i celler utan ett transportmedel.
Under åren har DeLisas grupp utvecklat ett brett utbud av intressanta och potentiellt effektiva proteinläkemedelskandidater. Tyvärr begränsades den praktiska användbarheten av dessa proteiner av frånvaron av en metod för intracellulär leverans. Medan genterapi – en biomedicinsk teknologi som kan ge en terapeutisk effekt genom att leverera en gen för uttryck i målceller – var ett alternativ, har metoden en rutig historia på grund av säkerhetsproblem hos människor.
"Vi hade letat efter ett smart sätt att effektivt få in våra konstruerade proteiner inuti celler, särskilt i ett translationellt sammanhang som inte bara skulle fungera i laboratorieodlade celler, utan som också skulle vara effektivt och säkert i djurmodeller och så småningom i människor ," sa DeLisa.
"När Azmain kopplade ihop vår grupp med Chriss grupp, var en av idéerna som dök upp, varför leverera detta som en genterapi när vi kunde leverera det som ett redan tillverkat protein? Och så det gjorde oss väldigt glada."
Alabis labb hade ställts inför egna utmaningar. Medan teamet hade erfarenhet av att leverera nukleinsyror till celler med hjälp av nanopartiklar, sa Alabi, de hade ännu inte hittat ett sätt att göra detsamma med "globular squishy mjuka proteiner" på grund av labbets begränsade erfarenhet av att producera tillräckliga mängder av proteinerna för testning.
"Vi såg detta som en bra brygga mellan våra forskargrupper, för att skapa det här nya utrymmet som jag inte tror att många människor arbetade på vid den tiden och göra det på ett sätt som kan vara skalbart och effektfullt," sa Alabi .
Forskarna hade den breda idén att använda en biokonjugeringsmetod som skulle göra det möjligt för proteinerna att laddas in i lipidnanopartiklar, som bildas runt nukleinsyror. En stor fördel med detta tillvägagångssätt var att lipidnanopartiklar var en nyckelkomponent i de framgångsrika covid-19-vaccinerna som utvecklats av Pfizer-BioNTech och Moderna.
"På den tiden tog den tekniken verkligen fart", sa Alamgir.
Dessa vacciner fungerade genom att leverera en nyttolast i form av budbärar-RNA, som är nukleinsyror. Forskarna skulle nu använda samma koncept för leverans av lipidnanopartiklar – samma material till och med – men med en nyttolast av protein. Tricket skulle vara att få proteiner att se mer ut som nukleinsyror.
Forskarna fann att de kunde åstadkomma detta genom att "dölja" proteinerna med en negativt laddad jon, så att de skulle ansluta sig till de positivt laddade lipiderna elektrostatiskt.
"Kruxet i vår strategi är konceptuellt väldigt enkelt," sa Alamgir. "Vi tar proteiner och omformar specifikt deras ytor med negativa laddningar, så att de ser ut som nukleinsyror och kan på liknande sätt sättas ihop till nanopartiklar när de formuleras med de karakteristiska lipiderna."
En svårighet som teamet stötte på var att de förhållanden under vilka nukleinsyror formuleras för att förenas med, eller komplexa, med lipiderna är ganska hårda – för hårda för proteiner.
"Vi var tvungna att använda mildare förhållanden och en något modifierad formulering där vi lade till extra lipider," sa Alabi. "Så både från proteinbiokonjugationssidan, och även från lipidsidan, var vi tvungna att justera formuleringen för att få detta att fungera så bra som det gör."
Teamet, som inkluderade doktoranden och medförfattaren Souvik Ghosal, demonstrerade framgångsrikt cloaking-metoden med lysinreaktiva sulfonerade föreningar, dödade cancerceller med ribonukleas A och hämmade tumörsignalering med monoklonala immunoglobulin G (IgG) antikroppar.
En ytterligare fördel med biokonjugationskemin som används av teamet är att processen är reversibel. Den kemiska taggen som läggs till proteinet släpper när den har kommit in i cellens cytoplasma. Och eftersom biokonjugationsmetoden är inriktad på lysin – en typ av aminosyra som finns rikligt i naturliga proteiner – kan tekniken replikeras för praktiskt taget vilket protein som helst.
"Detta har potential att ta många vanliga proteiner som för närvarande är tillgängliga från många biovetenskapsdistributörer och bioteknikföretag och återanvända dem för nya intracellulära tillämpningar," sa Alamgir.
Mer information: Azmain Alamgir et al, Bioreversible Anionic Cloaking möjliggör intracellulär proteintillförsel med joniserbara lipidnanopartiklar, ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071
Journalinformation: ACS Central Science
Tillhandahålls av Cornell University