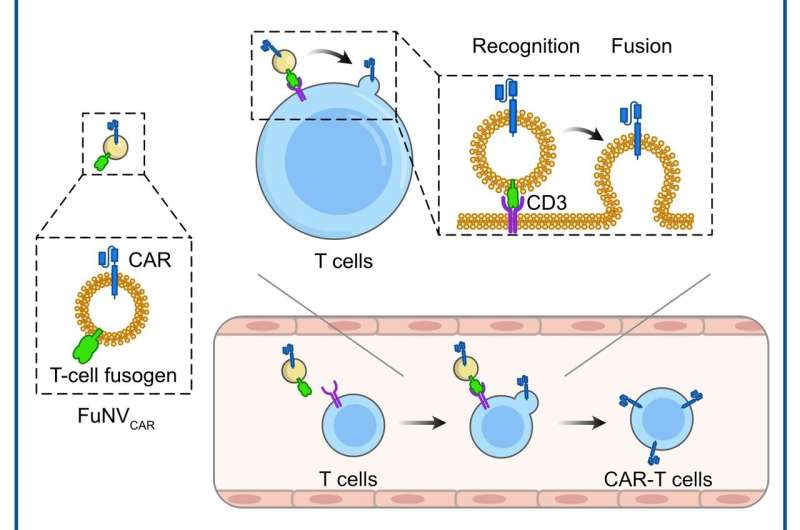
Chimära antigenreceptorer (CAR) är syntetiserade membranproteiner som gör det möjligt för lymfocyter att känna igen och svara på de specifika antigenerna i målceller. Trots den imponerande effekten av CAR-T-cellterapi vid behandling av B-cellslymfom eller leukemi, har den dyra och komplexa tillverkningsprocessen hindrat dess omfattande kliniska tillämpning.
Tidigare forskning har utforskat användningen av nanopartiklar för att leverera nukleinsyror för att programmera cirkulerande T-celler in vivo, strömlinjeforma CAR-T-cellgenerering och undanröja behovet av att isolera T-celler från patienter. Samtidigt kan ett införande av CAR-proteinet direkt i T-cellmembranet utgöra en enkel metod som kringgår komplikationer som cytokinfrisättningssyndrom (CRS) och den tumöriska risken förknippad med slumpmässig insättning av viral gen i genomet.
Ledda av Prof. Jun Wang och Prof. Cong-Fei Xu från School of Biomedical Sciences and Engineering vid South China University of Technology, har forskare utvecklat en lovande strategi som involverar direkt sammansmältning av CAR-molekyler, föruttryckta på fusogena nanovesiklar (FuNVs), till T-celler, och därigenom konstruerar CAR-T-celler in vivo.
De konstruerade T-cellsfusogenen genom att lägga till ett anti-CD3 enkelkedjigt variabelt fragment till reoviruset eller mässlingsvirusfusogenet. De visade att FuNVs härledda från T-cellsfusogen-uttryckande celler bar en betydande mängd T-cellsfusogen, vilket effektivt inducerade fusionen mellan NVs och T-celler både in vitro och in vivo.
Därefter, med tanke på den kliniska framgången för anti-CD19 (αCD19) CAR-T-celler, konstruerades de konstruerade cellerna som uttrycker T-cellsfusogen och αCD19 CAR-protein för att producera αCD19 CAR-bärande FuNVs (FuNVCAR ). CAR-T-cellproduktion uppnåddes framgångsrikt genom att leverera CAR-protein till T-celler via FuNVCAR in vitro och in vivo. Under tiden, intravenös injektion av FuNVCAR effektivt hämmade tillväxten av B-cellslymfom.
För att ytterligare utforska den potentiella toxiciteten hos FuNVCAR , utfördes blodvärden och biokemiska serumanalyser efter 2 dagar och 14 dagar, vilket visade på jämförbarhet med kontrollgruppen. Under hela behandlingen med FuNVCAR Inga signifikanta förändringar i kroppsvikt observerades hos möss.
Vidare, till skillnad från traditionell CAR-T-cellsbehandling, behandling med FuNVCAR inducerade inte en förhöjd frisättning av inflammatoriska cytokiner. Denna observerade skillnad kan tillskrivas transienta CAR-T-celler producerade av FuNVCAR , som genomgår begränsad och tillfällig aktivering, vilket minskar den fördröjda frisättningen av inflammatoriska cytokiner.
Sammanfattningsvis introducerar denna studie en ny metod för in vivo CAR-T-cellproduktion genom FuNV-medierad CAR-proteinleverans. Det är dock viktigt att notera att denna strategi kanske inte är lämplig för patienter med nedsatt T-cellsfunktion.
Resultaten publiceras i tidskriften Science Bulletin .
Mer information: Gui Zhao et al, In vivo-produktion av CAR-T-celler med användning av virusmimetiska fusogena nanovesiklar, Science Bulletin (2023). DOI:10.1016/j.scib.2023.11.055
Tillhandahålls av Science China Press