Aortaaneurysm är utbuktningar i aortan, det största blodkärlet som transporterar syrerikt blod från hjärtat till resten av kroppen. Rökning, högt blodtryck, diabetes eller skador kan alla öka risken för aneurysm, som tenderar att förekomma oftare hos kaukasiska manliga rökare över 65 år.
"De mjuka vävnaderna som utgör blodkärlen fungerar i huvudsak som gummiband, och det är de elastiska fibrerna i dessa vävnader som gör att de kan sträcka sig och knäppa tillbaka", säger professor Anand Ramamurthi, ordförande för institutionen för bioteknik vid Lehigh University's P.C. Rossin College of Engineering and Applied Science.
"Dessa fibrer produceras främst före och strax efter födseln. Efter det regenereras de inte eller genomgår naturlig reparation efter skada. Så när de blir skadade eller sjuka försvagas vävnaden och orsakar ett aneurysm, som kan växa med tiden. Efter cirka sju till 10 år, den når vanligtvis bristningsstadiet."
Under den perioden finns ingen behandling. Patienterna screenas regelbundet via bildbehandling för att övervaka hastigheten på aneurysmets tillväxt. När det väl bedöms vara tillräckligt stort för att potentiellt brista (en händelse som är dödlig 90 procent av tiden), är operation det enda alternativet. Men det är en risk för äldre patienter.
Ramamurthi och hans team arbetar på minimalt invasiva sätt att regenerera och reparera dessa elastiska fibrer med hjälp av polymera eller biologiska nanokapslar, kallade nanopartiklar, som är designade för att frigöra nya regenerativa terapier. Deras innovativa tekniker kan möjliggöra behandling strax efter att ett aneurysm har upptäckts och potentiellt sakta ner, vända eller till och med stoppa tillväxten.
Resultat från deras senaste artikel, publicerad i Journal of Biomedical Materials Research Part A , bygger vidare på deras tidigare arbete och representerar ett steg mot en framtid där operation inte längre är det bästa och enda behandlingsalternativet.
"I tidigare forskning har vi identifierat läkemedel och genljudande medel som faktiskt kan få vuxna sjuka kärlceller att producera nya elastiska fibrer och hämma enzymerna som bryter ner befintliga fibrer", säger han. "Vi har också arbetat på hur vi kan leverera dessa terapier effektivt endast på platsen för vävnadsreparation."
Teamet har också utvecklat en nanopartikeldesign som kallas aktiv målinriktning som innehåller små proteinfragment, eller peptider, på nanopartikelns yta. "Dessa peptider känner igen komponenter som är unika för aneurysmvävnaden. Så när nanopartiklarna injiceras i blodomloppet fastnar de bara på aneurysmväggen, där de långsamt bryts ned och frisätter läkemedlet.
För detta dokument, säger han, har forskarna "undersökt hur nanopartiklarna faktiskt penetrerar blodkärlsväggen för att leverera läkemedlet till den drabbade vävnaden."
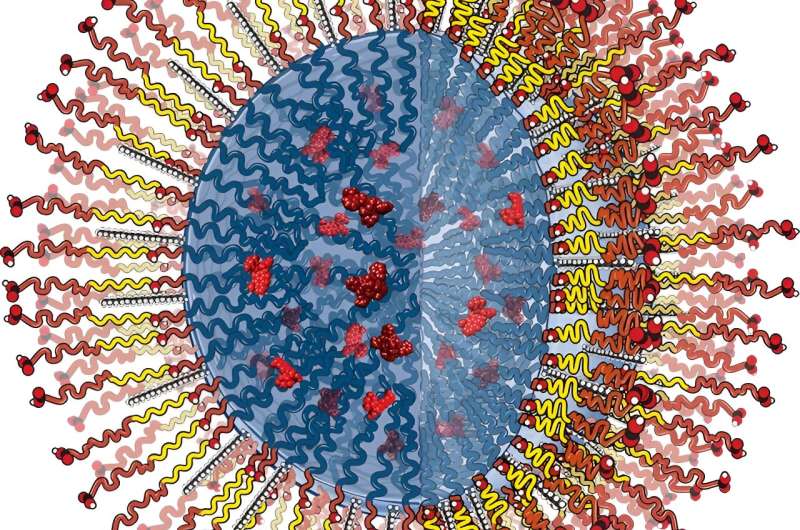
Alla blodkärl är fodrade med en skyddande barriär gjord av endotelceller, som kan bli "läckande" då inflammation från vävnadsskada eller sjukdom bryter ner endotelet och skapar luckor mellan cellerna. Dessa luckor tillåter vita blodkroppar att flytta in och starta vävnadsreparationsprocessen, och de fungerar också som ingångspunkten för nanopartiklar som påskyndar läkning.
"Vi ville veta hur formen och bildförhållandet för dessa nanopartiklar påverkar deras förmåga att passera den endotelcellsbarriären", säger Ramamurthi.
Det var en kritisk fråga att besvara eftersom inte alla nanopartiklar skapas lika, och om de inte kan penetrera barriären kan de inte reparera vävnaden.
Ramamurthi och hans team utvecklade en ny cellodlingsmodell där de simulerade sjukdom och sedan undersökte transportmekanismer, specifikt hur nanopartiklar av olika slag interagerade med endotelceller och rörde sig genom dem. Gick de in genom luckor mellan endotelcellerna (en process som kallas extravasation) eller genom själva cellerna (det som kallas translokation)?
"Låt oss säga att en nanopartikel går genom en endotelcell. En del av den kanske stannar i den cellen och inte kommer ut på andra sidan, vilket betyder att du förlorar den partikeln, och den är inte längre användbar för läkningsprocessen. Målet är transport med minimal retention."
Teamet fann att stavformade partiklar, i motsats till sfäriska partiklar, med ett högt bildförhållande (dvs långa och smala kontra korta och stubbiga) togs selektivt upp av sjuka endotelceller. "Och de visade väldigt lite upptag i friska endotelceller jämfört med sfärerna, vilket är bra eftersom vi inte vill att de ska interagera med friska kärlväggar", säger han.
De fann också att partiklar nådde vävnaden främst genom extravasation (eller via cellluckor). "Ju längre och smalare de var, desto mindre sannolikt var det att de skulle stanna kvar inom endotelcellslagret, vilket innebär att de tar sig igenom till den drabbade vävnaden för mer effektiv behandling."
Teamet kommer nu att integrera dessa fynd med sitt arbete med aktiv målinriktning – som innehåller komponenter på ytan av nanopartiklar som känner igen proteiner som uttrycks av sjuka celler – i djurmodeller.
Det slutliga målet är att utveckla en icke-kirurgisk regenerativ terapi som kan bromsa aneurysmtillväxt. Till exempel att öka det nuvarande tillväxt-till-brottstadiet från sju år till 15 år. Ett ännu mer ambitiöst resultat, säger Ramamurthi, skulle vara att återställa den tillväxten.
"Regression av aneurysmtillväxt skulle vara det föredragna långsiktiga resultatet", säger han. "Det är långt kvar, men vi är glada eftersom dessa fynd kommer att hjälpa oss att utforma våra nanopartiklar för mer effektiv leverans till aneurysmväggen. Det är en möjlighet att komma närmare den verkligheten."
Mer information: Jimmy Yau et al, Assessing trans-endotelial transport of nanopartiklar för leverans till abdominala aortaaneurysm, Journal of Biomedical Materials Research Part A (2024). DOI:10.1002/jbm.a.37667
Tillhandahålls av Lehigh University