Proteinbaserade läkemedel måste transporteras in i cellerna på ett sätt som förhindrar deras omedelbara nedbrytning. Ett nytt tillvägagångssätt är avsett att säkerställa att de förblir intakta endast i vissa celler, såsom cancerceller. I en studie publicerad i tidskriften Angewandte Chemie International Edition , har ett japanskt forskarlag introducerat en nanobärare som kan "rymma" från endosomer innan dess last förstörs där. Denna förmåga att fly utlöses endast inom endosomerna hos vissa tumörceller.
Upptaget av nanobärare i celler sker genom endocytos:När en nanobärare landar på cellytan viks cellmembranet in och omsluter det i en bubbla, kallad endosom, som sedan driver in i cellens inre. I sin sena fas smälter endosomen samman med lysosomer som innehåller enzymer och bildar en endolysosom. Inom denna struktur bryter enzymerna ner både material från kroppen och främmande material.
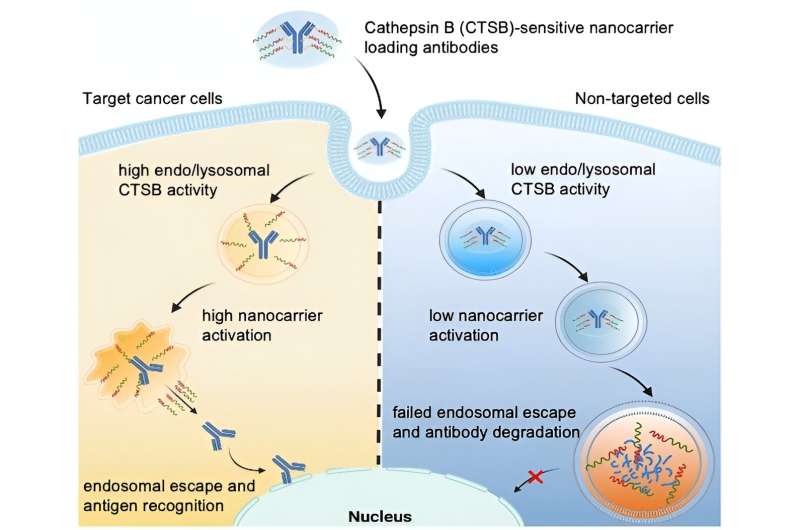
Ett proteinbaserat läkemedel kan bara bli aktivt om det "flyr" från endolysosomen innan det bryts ned. Detta är känt som "endosomal flykt". Vissa nanobärare kan öppna det endo/lysosomala membranet och har därmed endosomal flyktförmåga.
Leds av Kazunori Kataoka och Horacio Cabral, strävar teamet efter att ta detta ett steg längre genom att producera nanobärare för vilka endosomala flykt bara utlöses när de kommer in i mycket specifika celler, såsom tumörceller. Detta skulle skydda friska celler. Forskarna utnyttjar det faktum att olika typer av celler har väldigt olika endolysosomala enzymaktiviteter. Till exempel är aktiviteten av proteaset cathepsin B (CTSB) särskilt hög i cancerceller.
Med användning av speciella fluorescensprobmolekyler studerade teamet från Tokyos universitet och Kawasaki Institute of Industrial Promotion initialt CTSB-aktivitet och proteinnedbrytning i endosomer. De fastställde att i cancerceller med mycket sura endosomer, är CTSB-aktiviteten redan mycket hög i deras tidiga fas - avsevärt innan proteinnedbrytningen ökar. Forskarna drar fördel av detta tidsfönster genom att använda nanobärare vars endosomala flyktförmåga triggas av CTSB i cancerceller.
Teamet konstruerade poly(etylenglykol)-baserade nanobärare med diaminoetangrupper som kan "riva upp" endo/lysosomala membran. Med hjälp av en linker fäste de sedan antikroppar för att fungera som en modell för ett proteinläkemedel. Nanobäraren skyddar "avrivningsverktygen" så att de initialt är inaktiva.
Linkern är utformad för att delas av CTSB i endolysosomerna. Detta separerar lasten från bäraren och aktiverar rivverktygen. De öppnar det endo/lysosomala membranet och frigör intakta antikroppar i cellens inre – men bara i tumörceller som har förhöjd endosomal CTSB-aktivitet.
Denna metod skulle kunna representera en ny strategi för cellspecifik frisättning av läkemedel genom stimuluskänsliga nanobärare med kontrollerad endosomal flykt.
Mer information: Pengwen Chen et al, Selektiv intracellulär leverans av antikroppar i cancerceller med nanobärare som känner av endo/lysosomal enzymaktivitet, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317817
Journalinformation: Angewandte Chemie International Edition
Tillhandahålls av Wiley