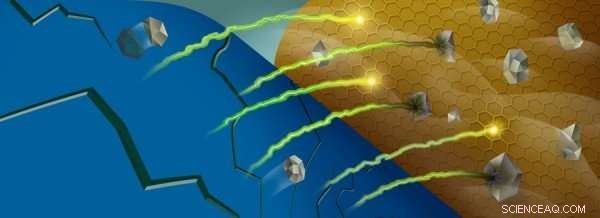
När manganjoner (grå) tas bort från ett batteris katod (blå), de kan reagera med batteriets elektrolyt nära anoden (guld), fångar litiumjoner (grön/gul). Kredit:Robert Horn/Argonne National Laboratory
Som du, jag och alla vi känner, batterier har en begränsad livslängd.
När ett batteri når "ålderdomen, " forskare hänvisar till dess minskade prestanda som "kapacitet blekna, " i vilken mängden laddning ett batteri kan leverera minskar vid upprepad användning. Kapaciteten bleknar är anledningen till att ett mobiltelefonbatteri som brukade räcka en hel dag kommer, efter ett par år, varar kanske bara några timmar.
Men tänk om forskare kunde minska denna kapacitetsfading, låta batterierna åldras mer elegant?
"Nu när vi känner till mekanismerna bakom fångsten av litiumjoner och kapaciteten bleknar, vi kan hitta metoder för att lösa problemet."
Forskare vid U.S. Department of Energys (DOE) Argonne National Laboratory identifierade en av de största bovarna i kapacitetsblekning av högenergiska litiumjonbatterier i en artikel publicerad i The Journal of the Electrochemical Society.
För ett litiumjonbatteri – den typ som vi använder i bärbara datorer, smartphones, och laddhybridbilar – batteriets kapacitet är direkt kopplad till mängden litiumjoner som kan skjutas fram och tillbaka mellan batteriets två poler när det laddas och laddas ur.
Denna skyttelning möjliggörs av vissa övergångsmetalljoner, som ändrar oxidationstillstånd när litiumjoner rör sig in och ut ur katoden. Dock, när batteriet cyklas, några av dessa joner – framför allt mangan – tas bort från katodmaterialet och hamnar vid batteriets anod.
Väl nära anoden, dessa metalljoner interagerar med en del av batteriet som kallas fast-elektrolyt-interfasen, som bildas på grund av reaktioner mellan den mycket reaktiva anoden och den flytande elektrolyten som transporterar litiumjonerna fram och tillbaka. För varje elektrolytmolekyl som reagerar och bryts ner i en process som kallas reduktion, en litiumjon fastnar i mellanfasen. När mer och mer litium fastnar, batteriets kapacitet minskar.
Vissa molekyler i denna interfas är ofullständigt reducerade, vilket innebär att de kan ta emot fler elektroner och binda upp ännu fler litiumjoner. Dessa molekyler är som tinder, väntar på en gnista.
När manganjonerna deponeras i denna interfas fungerar de som en gnista som tänder tindern:dessa joner är effektiva för att katalysera reaktioner med de ofullständigt reducerade molekylerna, fånga fler litiumjoner i processen.
"Det finns en strikt korrelation mellan mängden mangan som tar sig till anoden och mängden litium som fastnar, " sa studiemedförfattaren och Argonne-forskaren Daniel Abraham. "Nu när vi vet mekanismerna bakom fångsten av litiumjoner och kapaciteten bleknar, vi kan hitta metoder för att lösa problemet."