
Universitetet i Groningen forskare Dr. Hein Wijma (vänster) och Prof. Dr. Dick B. Janssen, som använde en ny beräkningsmetod för att omforma aspartasenzymet och omvandla det till en katalysator för asymmetriska hydroamineringsreaktioner. Kredit:University of Groningen
Bioteknologer från University of Groningen använde en beräkningsmetod för att omforma aspartas och omvandla det till en katalysator för asymmetriska hydroamineringsreaktioner. Deras kollegor i Kina skalade upp produktionen av detta enzym och lyckades producera kilogram mycket rena byggstenar för läkemedel och andra bioaktiva föreningar. Denna framgångsrika proof of principle-studie publicerades i Naturens kemiska biologi den 21 maj.
Enzymer är naturliga katalysatorer som fungerar under milda förhållanden. De är ett attraktivt alternativ till okatalyserade kemiska reaktioner som ofta kräver energikrävande höga temperaturer eller tryck och som kan generera giftiga biprodukter eller använda lösningsmedel. Men det finns ett problem:Omfånget av reaktioner som katalyseras av enzymer är begränsat. "Det är därför mycket ansträngning läggs på att modifiera naturliga enzymer, " förklarar Dick Janssen, Professor i kemisk bioteknik vid Groningen Biomolecular and Biotechnology Institute.
Den klassiska metoden för att modifiera enzymer är riktad evolution, en mutations-selektionssekvens i labbet som syftar till att skapa enzymer med modifierade katalytiska förmågor. Men det krävs mycket arbete för att tillverka och testa hundratals eller tusentals enzymvarianter i flera omgångar. Det skulle vara mycket effektivare att göra en rationell design av de förändringar som krävs baserat på information om enzymets struktur och egenskaper.
Men även detta är komplicerat, förklarar Hein Wijma. Han är expert på mjukvara för molekylär design och gjorde det mesta av beräkningsarbetet i studien. "Proteiner är gjorda av 20 olika aminosyror. Så om du vill ändra ett enzym i fyra positioner, det finns 20 alternativ för var och en av dem. Det resulterar i en enorm matris av proteinstrukturer." Testar dem en efter en, även på datorn, tar för lång tid. Dock, en mycket snabb Monte Carlo-sökalgoritm påskyndar upptäckten av det rätta resultatet genom att leta efter trender i enzymets reaktivitet.
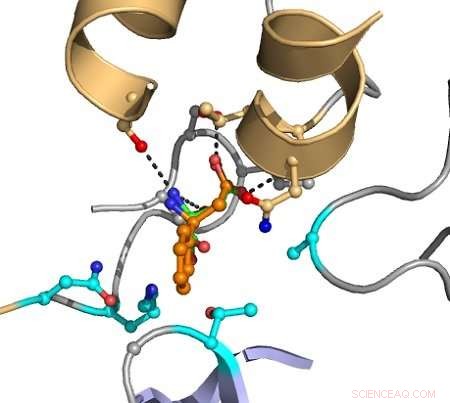
De streckade linjerna indikerar interaktioner mellan atomer som orsakar katalys. Målsubstratet visas i orange, och grupperna indikerade i magenta varieras i datorn för att upptäcka mutanter som förbättrar omvandlingen. Kredit:Hein Wijma/University of Groningen
"I slutet, det tog ett par dagar att utföra denna sökning i ett dedikerat datorkluster vid universitetet i Groningen, " säger Wijma. Men det behövdes mycket modellering i förväg. "Du måste modellera det reaktiva centret, fickorna där substratet binder, och bestämma avståndet mellan aminosyrorna och deras relativa positioner och vinklar." Eftersom gruppen använde ett enzym (aspartas) som utgångspunkt för ett antal olika reaktioner, utgångspunkten var alltid densamma. Detta innebar att de bara behövde ändra målreaktionen. Wijma:"Om vi ville göra en ny modifiering av aspartas, det skulle förmodligen bara ta tre månader nu."
Forskningsuppsatsen beskriver fyra konverteringar, alla tillsatser av ammonium. Aspartas är ett deaminas, så reaktionen var omvänd. "Katalys går åt båda hållen, så det är inget större problem, " säger Janssen. För varje konvertering, det initiala urvalet av algoritmen gav ett hundratal lovande mutanter. Dessa kontrollerades sedan för uppenbara fel. Janssen:"Till slut, ungefär fem till 20 mutanter gjordes faktiskt i labbet och testades för att se om de fungerade som förväntat."
Nästa steg var att testa framgångsrika muterade enzymer i en uppskalad miljö. "Detta arbete gjordes av en före detta doktorand och postdoc från vårt labb, Bian Wu, som nu är biträdande professor i Kina, ", säger Janssen. "Han visade vilka kandidater som kunde producera stora mängder av den erforderliga produkten." Substratomvandlingar på 99 procent med en enantioselektivitet på 99 procent uppnåddes i kvantiteter upp till ett kilogram, vilket betyder att de enzymer som förutspås av beräkningsmetoderna verkar lämpliga för användning i en industriell miljö. "Detta är ett verkligt principbevis på att vår metod för in-silico-selektion av mutanter fungerar för att producera användbara enzymer, avslutar Janssen.