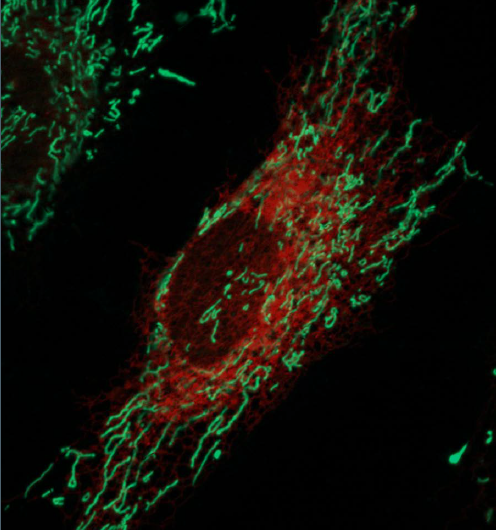
Levande avbildade HeLa-celler med endoplasmatisk retikulum märkt rött och mitokondrier märkta grönt. Upphovsman:Ginam Cho.
Inuti varje cell finns en komplex infrastruktur av organeller som utför olika funktioner. Organeller måste utbyta signaler och material för att få cellen att fungera korrekt. Ny teknik gör det möjligt för forskare att se och förstå nätverken som förbinder dessa organeller, så att de kan bygga kartor över de handelsvägar som finns inom en cell. En studie som ska publiceras i numret av den 29 september Journal of Biological Chemistry rapporterar användningen av en framväxande metod för att identifiera proteiner som tillåter två organeller, mitokondrier och endoplasmatisk retikulum, att fästa vid varandra.
"Tänk på [en organell] som en färja som lägger till vid en plats, lossning och lastning av passagerare och bilar, och sedan gå till en annan sida och göra samma sak, sa Jeffrey Golden, en professor vid Brigham and Women's Hospital och Harvard Medical School som övervakade arbetet. "Deras förmåga att lägga till, ladda, och lossning av last kräver guider eller ramper med specifik bredd och höjd som förbinder båten och land eller så kan de inte fritt lasta och lossa."
Kontaktpunkter mellan endoplasmatiska retikulum (ER) och mitokondrier är de "ramper" och "guider" som möjliggör dessa kontakter. De tillåter viktiga aktiviteter som signalering, utbyte av kalcium och lipider, och kontroll av mitokondriell fysiologi. Felaktiga samband mellan ER och mitokondrier har varit inblandade i flera neurodegenerativa sjukdomar, inklusive Alzheimers, Parkinsons och Huntingtons sjukdom. Proteinerna som förbinder och överbryggar ER och mitokondrierna är väl studerade i jäst, men kopplingarna mellan dessa organeller i flercelliga organismer som däggdjur är mer komplexa och mindre förstådda.
Guldens samarbetspartner Ginam Cho och forskare Il-Taeg Cho hade idén att söka efter proteiner som är viktiga för ER-mitokondriell kontakt med en metod som nyligen utvecklats för att visa kontakt mellan proteiner. Metoden drar fördel av ett enzym som kallas askorbatperoxidas, eller APEX, som kan fästa biotin allmänt känt som vitamin B7 till proteiner i närheten. Teamet konstruerade celler för att producera mitokondrier som hade APEX fäst vid sina yttre membran, och tillsatte sedan biotin till cellerna för APEX att använda för att märka närliggande proteiner.
Teamet isolerade sedan delar av cellen som innehöll akuten, renat de proteiner som hade biotin fäst, och identifierade de som finns i ER med hjälp av masspektrometri. Eftersom APEX var fäst vid mitokondrier, bara de proteiner som kom i närheten av mitokondrier kunde ha fått biotin fäst. Således, biotinet fungerade som ett slags passstämpel som angav vilka proteiner som hade varit inblandade i ER-mitokondriekontakten.
"Det var tidigare möjligt att bara titta på en molekyl i taget för att bedöma vad den interagerade med, "Sade Golden. "Den metod vi har använt är snabbare och tillåter en opartisk titt på ett helt system och vad som händer vid organellens gränssnitt."
Med hjälp av denna screeningmetod, forskarna nollade in sig på ett ER -protein som heter RTN1a, som tidigare var känt för att bidra till ER -formen. I uppföljande experiment, de bekräftade att detta protein också hjälpte mitokondrier att fästa vid ER.
Denna studie tar upp möjligheten att defekter i RTN1a kan bidra till de problem som patienter med neurodegenerativa sjukdomar upplever, men forskarna vet inte säkert förrän de genomför ytterligare experiment inklusive liknande studier i neurala celler.
Golden spekulerar i att proteinerna som är viktiga för ER-mitokondriell kontakt kan vara olika i olika celltyper.
"Använder levern samma proteiner för att kontrollera dessa typer av interaktioner som neurala celler gör? Är ett [protein] viktigare för kalciumutbyte och en annan uppsättning proteiner viktigare för lipidutbyte?" frågade Golden. "Jag tror att det finns mycket cellbiologi som vi bara inte känner till och som kan besvaras [med denna metod]."
Teamet använder nu APEX-masspektrometrimetoden för att jämföra proteiner involverade i ER-mitokondriella kontakter mellan normala och patienthärledda neurala celler.
"Det finns många intressanta saker vi kan göra, " sa Il-Taeg Cho.