Kombinatoriska bibliotek är en nyckelkomponent i kemistens verktygslåda för ligandscreening. Dynamiska kombinatoriska bibliotek tillför en ny dimension genom att länka samman syntes och screening. Nu, Brittiska forskare har utvecklat ett dynamiskt kombinatoriskt bibliotek för screening av supramolekylära ligandstrukturer som känner igen proteinytor och kan störa protein-proteininteraktion. Studien har publicerats i European Journal of Organic Chemistry .
Kombinatorisk kemi har anammats av läkemedelsindustrin eftersom den tillåter kemister att skapa stora mängder molekyler och testa dem för önskade egenskaper, till exempel, bindningsaffiniteter till ett terapeutiskt viktigt mål. Syntes och screening är kopplade i dynamisk kombinatorisk kemi eftersom de dynamiska kombinatoriska biblioteken kan förändra sin produktdistribution som svar på målbindning. Denna produktförstärkningsprocess genererar supramolekylära strukturer som annars är svåra att komma åt och möjliggör snabb identifiering av bindande arkitekturer, till exempel, hämmare som binder till det aktiva stället för ett enzym.
Dock, proteinytor är stora tredimensionella strukturer med fläckar av olika hydrofobicitet, aciditet, och basicitet, finns i olika positioner på sin yta. Därför, screeningen av hämmare av protein-protein-interaktioner måste involvera mer komplexa ligander än de som behövs för aktiv platsigenkänning "Vi behövde identifiera reversibel kemi och analytisk metodik som skulle vara förenlig med idén om att göra dynamisk kombinatorisk kemi för proteinytigenkänning, " säger Andrew J. Wilson, motsvarande författare till studien som genomfördes vid University of Leeds.
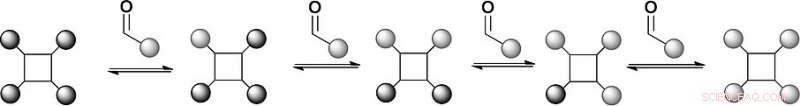
Forskarna valde en tetrafenylporfyrinställning som bär fyra hydrazider och substituerade bensaldehyder som igenkänningsarmar som reversibelt skulle länka till hydraziderna för att bilda hydrazoner. Porfyrinerna är etablerade byggnadsställningar för proteinyteigenkänning, men hydrazonkemin är syntetiskt utmanande. "Vi har en ställning med fyra hydrazoner så att vi kan byta kemi på fyra olika positioner, säger Wilson. Dessutom, reversibel hydrazonbildande kemi äger vanligtvis rum vid ett surt pH, men proteiner föredrar ett neutralt pH. Forskarna åtgärdade detta problem genom att lägga till en anilinbaserad katalysator, vilket drev hydrazonutbytesreaktionen mot termodynamisk jämvikt vid nära neutralt pH.
I den första installationen av detta modellbibliotek, forskarna provade två substituerade aldehydligander, som bildade en jämvikt med den bensaldehyd-härledda hydrazonen. Masspektrometrianalys visade att produktfördelningen var i termodynamisk jämvikt, och liganderna utbyttes verkligen genom reversibel reaktion. Detta innebär att villkoren för ett dynamiskt kombinatoriskt bibliotek för proteinytigenkänning ställdes. Nästa, forskarna planerar att utveckla denna metod för att studera det proteinriktade urvalet av proteinytmimetika.