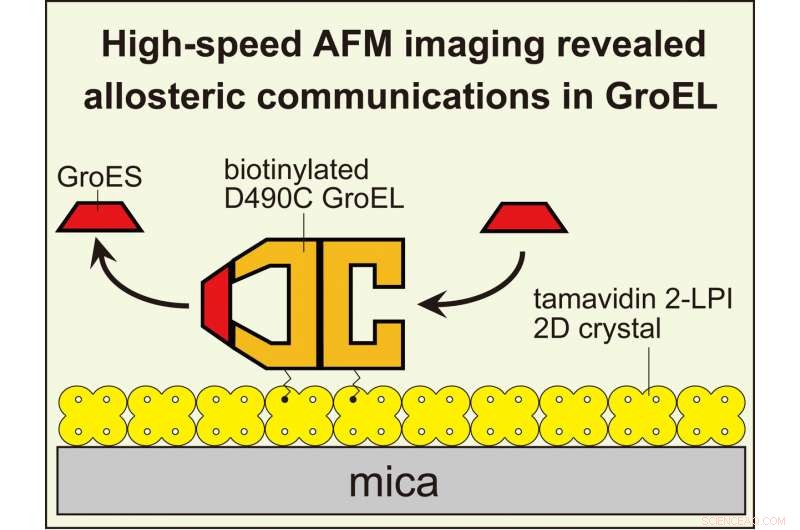
HS-AFM-avbildning avslöjade allosterisk interring-kommunikation i GroEL som styr dess chaperoninreaktion. För att visualisera dynamiska GroEL-GroES-interaktioner med höghastighets AFM, GroEL biotinylerad vid dess ekvatoriala domäner var bunden till den tvådimensionella kristallen av tamavidin 2-LPI som bildades direkt på glimmerytan. Upphovsman:Kanazawa University
Proteiner måste vikas på ett specifikt sätt för att fungera. Detta får ofta hjälp av molekylära chaperoner - små proteiner vars uppgift är att hjälpa andra att vika sig till rätt form. Nu, Japanska forskare har upptäckt att åtminstone för en molekylär chaperon, det finns mer i processen än man misstänkte.
I en tidning i Filosofiska transaktioner av Royal Society , den Kanazawa-ledda gruppen fokuserade på GroEL, som är avgörande för proteinveckning i bakterier. Den grova konturen förstås:GroEL fångar upp ett utfälld målprotein (substratet) i en hålighet, där den kan vikas ihop korrekt utan att samlas. Dock, de mekanistiska detaljerna är svåra att reda ut med traditionella ensemblemetoder. I den nya studien, höghastighets atomkraftsmikroskopi (HS-AFM) användes för att visualisera händelser mer direkt.
GroEL är en cylinderformad molekyl, gjord av två ringar staplade rygg mot rygg. En viktig partner i dess funktion är GroES, en ringformad "co-chaperonin" som binder till varje ände av GroEL som ett kupolformigt lock. Endast när GroEL begränsas av GroES kan det fånga substratproteinet. Sedan, när vikningen är klar, GroES tar avstånd från GroEL, och det vikta substratet frigörs.
Där det blir disigt är hur de två ringarna i vardera änden av GroEL samarbetar. Ringarna är identiska, och båda kan begränsas av GroES. När bara ena änden är täckt, det resulterande komplexet kallas en "kula", i kraft av sitt spetsiga utseende. Under tiden, formen med båda ändarna täckta kallas en "fotboll", eftersom dess symmetriska ovala form liknar en gallerboll.

GroES associations- och dissociationshändelser fångade av HS-AFM-avbildning. Även om reaktionen huvudsakligen fortskrider på ett alternativt sätt som B? ? F ? B? ? F (B och F representerar kul- och fotbollskomplex, respektive, och de vertikala pilarna indikerar polariteten hos kulkomplex), det förekommer ibland på olika sätt. Upphovsman:Kanazawa University
"I en konventionell modell, kapslingens cykel, proteinveckning, och avlockning växlar mellan varje ring, " säger studiens medförfattare Daisuke Noshiro. "Cappning vid en ring av GroEL (som har cis-stereokemi) förhindrar samtidig kapning i den andra (trans) änden. Sådan intramolekylär kommunikation är känd som allosteri." Enligt detta synsätt, den enkla kulan är den aktiva formen av GroEL, och fotbollen är bara en kortlivad mellangång mellan cyklerna.
Andra fynd, fastän, har antytt större komplexitet – vilket har belysts av denna nya studie. Beroende på substrattyp, GroEL dök upp som en fotboll, snarare än en kula, upp till 67 % av tiden, vilket innebär en nedbrytning av negativ allosterisk reglering. Detta var vanligast när substratet var ett ovikbart protein eller det inte fanns något substrat alls, men även med vikbara underlag, fotbollskomplex i överflöd.
Mer oväntat, cykeln skedde genom två olika vägar. I den dominerande typ I, när den aktiva ringen av GroEL slutför sin uppgift och den andra änden tar upp stafettpinnen, de två ringarna utbyter också cis- och transkonformationer. Dock, cirka 25 % av tiden (i typ II), konformationerna är inte utbytta, stör cirkuläret, alternerande rytm av typ I. Icke desto mindre, proteinveckning förekommer fortfarande. Fotbollar är vanliga i båda fallen.
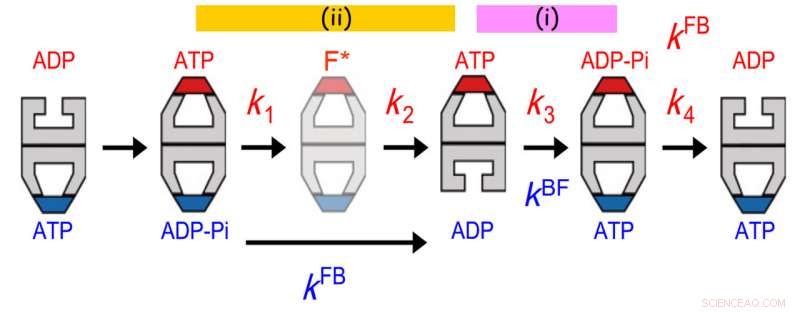
Allosterisk kommunikation mellan två ringar av GroEL. Livstidsfördelningen av bunden GroES passade bäst till en sekventiell fyrastegsreaktionsmodell med fyra hastighetskonstanter, k1, k2, k3 och k4. Värdet på k3 stämde överens med värdet för övergången från kula till fotboll (kBF) i den motsatta ringen. Dessutom, värdet 1/k1 + 1/k2 överensstämmer med värdet 1/kFB (kFB, hastigheten för fotboll-till-kula-övergång i motsatt ring). Det tidigare avtalet indikerar att ATP-hydrolys till ADP-Pi på en ring fungerar som en tidshållare för ADP-frigöring från den motsatta transringen, säkerställa frisättning av substratprotein från trans-ringen innan den täcks med GroES. Det senare avtalet indikerar att en händelse som inträffar i det andra steget efter ATP-bindning utlöser Pi-frisättning från den motsatta ringen. Upphovsman:Kanazawa University
"Fotbollsstrukturen är så riklig, det måste spela en mer aktiv roll än vi trodde, " säger motsvarande författare Toshio Ando. "Denna komplexa mekanism är viktig, eftersom chaperoniner är en naturlig klass av molekylära maskiner. Subtiliteterna i GroEL kan hjälpa oss att förstå allosterins roll i molekylära maskiner mer generellt."