Kredit:Wiley
Vissa användbara läkemedel består av peptider som verkar på deras proteinmål. För att göra dem mer effektiva och stabila, forskare har hittat ett sätt att ersätta viktiga segment av peptiderna med ureidoenheter. Dessa oligoureas, som är sammansatta av ureabaserade enheter, vikas till en struktur som liknar den för peptider. Oligourea-baserade "falska" peptider förbättrar alternativen för rationell läkemedelsdesign, avslutar studien publicerad i tidskriften Angewandte Chemie .
Flera läkemedel är peptider som hämmar eller aktiverar verkan av vissa proteiner. För att förbättra deras effektivitet, forskare undersöker peptidhärmare. Peptidhärmare innehåller strängar av små organiska enheter som liknar aminosyror - peptidernas byggstenar - men är inte identiska med dem. Skälet är att proteolytiska enzymer mindre sannolikt kommer att attackera sådana falska peptidsträngar, så drogerna skulle vara effektivare.
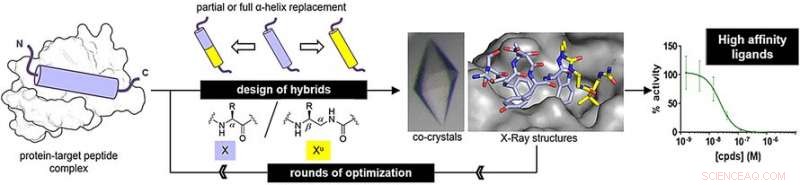
Dock, de syntetiska strängarna – kallade oligomerer – måste vikas in i den ursprungliga peptidens struktur för att binda till sitt målprotein på rätt sätt. Gilles Guichard och hans team från CNRS, Universitetet i Bordeaux, och kollegor från universitetet i Strasbourg och Ureka Pharma, Mulhouse, Frankrike, har utforskat oligomerer gjorda av ureidoenheter, som är derivat av urea. Dessa oligoureas vikas till en spiral, en av de kännetecknande strukturerna för peptider. Dock, det finns små skillnader. "Oligourea-spiraler har färre rester per varv, en mindre ökning per varv, och en större diameter än den ursprungliga peptiden alfa-helix, säger Guichard.
För att avgöra om oligourea kan efterlikna verkliga peptidstrukturer, forskarna beredde peptid-oligourea-hybrider och undersökte deras bindning till målproteiner. Ett av målen, MDM2, är en naturlig regulator av tumörsuppressorproteinet p53. Den andra, VDR, är ett protein som krävs för att reglera celltillväxt, immunitet, och andra biologiska funktioner.
För MDM2-bindande peptidhärmare, forskarna beredde hybrider genom att ersätta tre terminala nyckelaminosyror med ureidoenheter. För VDR-bindande peptidhärmare, de ersatte det mellersta aminosyrasegmentet med ureidoenheter. Efter några omgångar av optimering, författarna fann hybridstrukturer med hög bindningsaffinitet.
Bindningsaffiniteterna liknade de för de ursprungliga peptiderna. Dessutom, Röntgenanalys visade att hybridstrukturerna antog en vanlig spiralformad struktur. Dock, helixarna var fortfarande lite bredare och hade större utrymmen mellan sidokedjorna längs oligourea-ryggraden än de för naturliga peptider.
Peptid-oligourea-hybrider förväntas motstå proteolytisk nedbrytning, ett viktigt mål inom medicinsk kemi. En annan fördel är att de tillåter fler modifieringar. "Alfa-aminosyror kan ersättas på två positioner, men ureido-enheter har en plats till, " säger Guichard. Detta betyder att hybridpeptid-oligourea-läkemedel erbjuder fler alternativ för optimering.