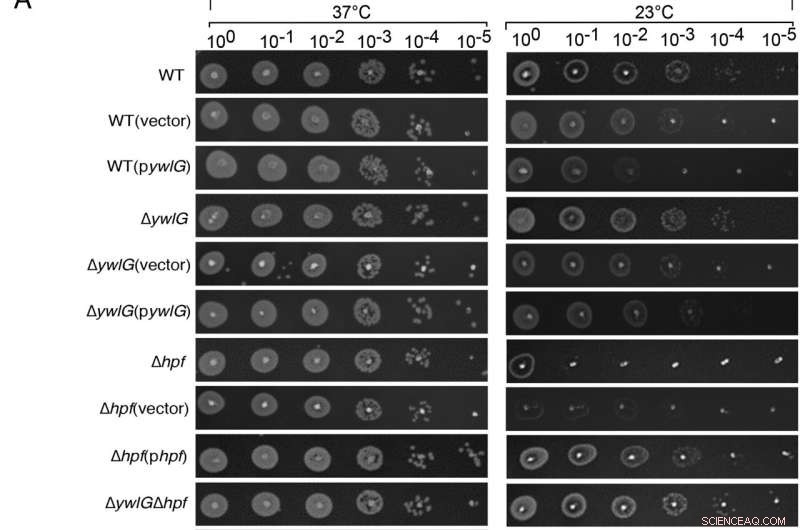
Inaktivering av ywlG undertrycker kylkänsligheten hos en Δhpf-null-mutant på ett mediumberoende sätt. Komplementering med plasmidkodad ywlG och hpf bekräftade den YwlG-medierade suppressionen och HPF-beroende köldresponsen. Seriella utspädningsfläckanalyser utfördes på (A) lysogenbuljong (LB)-baserad eller (B) tryptisk sojabuljong (TSB)-baserad agarplattor. Exponentiellt växande celler (OD600 =0,6) i TSB justerades till OD600 =0,2 efter två tvättar i 1xPBS. Efter serieutspädningar placerades 2 µL av varje spädning på agarplattorna. Resultaten registrerades efter 24 timmars och 48 timmars inkubation vid 37°C respektive 23°C. Bilderna är representativa för tre oberoende experiment. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2207257119
Northwestern Medicine-utredare har avslöjat nya regleringsmekanismer som främjar bakteriell överlevnad, enligt resultat publicerade i Proceedings of the National Academy of Sciences .
Studien, ledd av M.-N. Frances Yap, Ph.D., docent i mikrobiologi-immunologi, lägger också grunden för att identifiera nya terapeutiska mål för att behandla bakterieinfektioner.
Ribosomdvala är en mekanism som utförs av bakterier och andra organismer inklusive eukaryoter för att säkerställa långsiktig överlevnad. Hibernerande 100S-ribosomer i bakterier består av två 70S-komplex sammanfogade av ett protein som främjar vilolägesfaktorn (HPF).
Detta 100S-komplex tjänar två huvudsakliga syften:att förhindra nedbrytning av proteinbiosyntesmaskineri (ribosomer) och att spara energi i cellen genom att stänga av mRNA-translation.
I den aktuella studien använde Yaps team masspektrometri för att studera proteininteraktioner i meticillinresistenta Staphylococcus aureus, en bakterie som är allmänt känd för att orsaka staph-infektioner. Från dessa analyser fann de att HPF interagerar med en tidigare oidentifierad bindningspartner belägen utanför ribosomen, ett protein som kallas YwlG.
Genom att lösa YwlG:s atomstruktur fann de dessutom att detta protein är involverat i glutamathydrogenasaktivitet, vilket är en viktig metabolisk väg som krävs för bakteriers överlevnad.
"Under normala förhållanden är en del av YwlG-proteinet bundet till HPF. Genom att binda ihop kan YwlG inte stimulera glutamathydrogenasaktivitet och HPF kan inte binda till ribosomen, så det är "ömsesidig sekvestrering" av de två proteinerna för att säkerställa rätt mängd av 100S-komplex och cellulärt glutamatdehydrogenas produceras," sa Yap.
Fynden pekar på både HPF och YwlG som faktorer som påverkar bakteriell kolonisering och infektionsgrad. Slutmålet, enligt Yap, är att identifiera en förening som kan störa bildningen av dessa komplex och i sin tur hämma långtidsöverlevnad av bakterier.
"En viktig fördel är att protein som liknar HPF eller YwlG inte finns hos människor, så du kan utveckla ett HPF- eller YwlG-riktat antibakteriellt medel som hämmar bakterietillväxt men inte skadar värdarna," sa Yap. + Utforska vidare