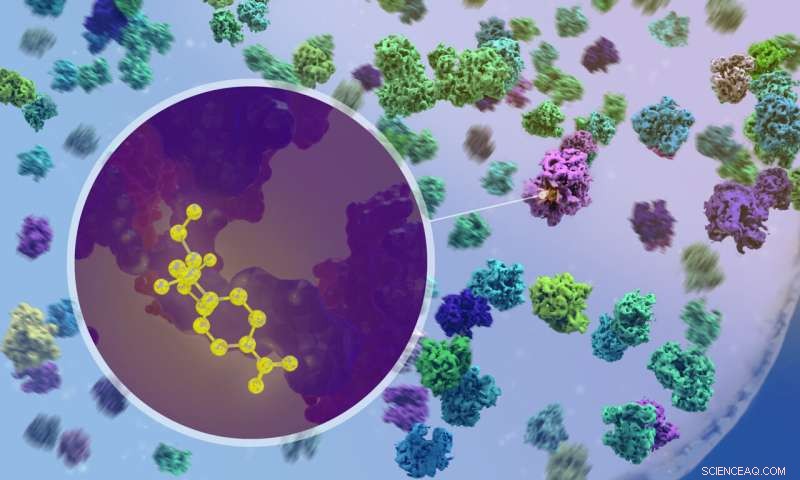
Forskare använde kryoelektrontomografi för att visualisera hur antibiotika binder till ribosomer inuti bakterier. Kredit:Isabel Romero Calvo/EMBL
Varje levande cell är beroende av proteiner för att fungera och processen för proteinsyntes - översättning - är avgörande för överlevnad. Bakterier är inget undantag, med molekylära maskiner involverade i translation är ett av de vanligaste målen för antibiotika.
Nu, för första gången, har forskare under ledning av Julia Mahamids grupp vid EMBL Heidelberg visualiserat i detalj hur antibiotika påverkar processen för proteinproduktion inuti bakterieceller. Denna studie, publicerad i Nature, markerar också första gången då forskare har observerat strukturella förändringar på atomnivå i det aktiva översättningsmaskineriet direkt inuti en cell, snarare än att använda isolerade molekyler i ett provrör. Viktigt är att detta tillvägagångssätt gjorde det möjligt för dem att identifiera mekanismer som sådana maskiner använder för att "prata" med varandra inuti celler.
Studien genomfördes i samarbete med forskare från Max-Planck-Institute for Biophysical Chemistry, Göttingen, Wellcome Centre for Cell Biology, University of Edinburgh och Technische Universität Berlin. Forskningen involverade också bidrag från grupperna Zimmermann-Kogadeeva och Bork vid EMBL Heidelberg, som hjälpte forskarna att utföra bioinformatiska analyser för att observera hur mångfalden i ribosomala proteiner ser ut över>4000 representativa bakterier.
Minuskulära bakterier och molekylära maskiner
Mahamid och hennes team är experter på att studera bakterien Mycoplasma pneumoniae med en teknik som kallas kryo-elektrontomografi (cryo-ET). Denna lilla bakterie, som orsakar atypisk lunginflammation hos människor, har ett fullt fungerande proteinsyntesmaskineri, trots att den bara är ungefär tiotusendels millimeter stor.
"Vi valde Mycoplasma för våra studier eftersom de är bland de minsta och mest minimala levande cellerna och har använts i stor utsträckning som modellceller i systembiologi och syntetisk biologi", säger Liang Xue, postdoc i Mahamid-gruppen och första författare till studien.
Cryo-ET tillåter forskare att ta seriebilder av blixtfrysta biologiska prover med hjälp av ett elektronmikroskop och kombinera de resulterande bilderna för att bilda en tredimensionell bild av en cell - ungefär som en mini-MRI-maskin. "Med storskalig cryo-ET-data från orörda bevarade celler är det möjligt att fånga högupplösta ögonblicksbilder av olika tillstånd av en molekylär maskin i aktion och kombinera dem till en film", sa Mahamid.
En av de mest framträdande strukturerna när man tittar på en kryo-ET-bild av en Mycoplasma-cell är små mörka bläckar - dessa är ribosomerna. "Ribosomen är en av de äldsta makromolekylära maskinerna, som kan ha funnits till och med före uppkomsten av celler," sa Xue. Ribosomer är de primära molekylära maskinerna som är involverade i proteinöversättning, och de finns i alla celler – från bakterier till människa.
Mahamid-gruppens tillvägagångssätt gjorde det möjligt för dem att inte bara upptäcka och räkna ribosomerna inuti bakterierna, utan också se deras struktur i atomär upplösning. Genom att studera ett stort antal ribosomer "frysta" i olika stadier av deras aktivitetscykel, kunde forskarna dechiffrera hur ribosomstrukturen förändras när den fortsätter genom proteinsyntesprocessen. Inte bara detta, utan de kunde också lokalisera ribosomerna i det tredimensionella utrymmet inuti cellen, vilket gjorde det möjligt för dem att identifiera hur översättningsprocessen är organiserad spatialt.
"Inuti levande celler fungerar ribosomer som mycket sammanlänkade system, snarare än enskilda molekylära maskiner," sa Xue. "Vi avslöjade nya funktioner i ribosomer och de olika reaktionsvägarna för translation i celler."
Antibiotika i aktion
Av avgörande betydelse, med hjälp av cryo-ET, kunde forskarna observera vad som händer när antibiotika kommer in i cellen och binder till ribosomer. Till exempel kunde de bekräfta att de två bredspektrumantibiotikan kloramfenikol och spektinomycin binder till olika platser på ribosomen och stör olika steg i proteinsyntesprocessen. Detta hade förutspåtts av studier på isolerade ribosomer, men aldrig tidigare observerats i verkan inuti en verklig bakteriecell.
"Det var väldigt spännande när vi först kunde se läkemedelsmolekylen binda till en ribosom inuti cellen," sa Xue. "Men det var ännu mer spännande när vi fann att ribosompopulationerna i antibiotikabehandlade celler är fundamentalt omformade - funktionellt, strukturellt och spatialt."
Forskarna observerade att interaktionerna mellan ribosomer och andra komplex i cellen förändrades som svar på läkemedlet, vilket tyder på att ett antibiotikum kan ha en effekt som sträcker sig långt utöver det specifika komplexet det binder till. "Å ena sidan kan detta hjälpa till att förstå effekterna av antibiotika utanför målet, och kan också hjälpa till att utforma kombinationer av antibiotika för att öka deras effektivitet", säger Mahamid.
Mahamid-gruppen fortsätter att använda kraften hos cryo-ET för att studera grundläggande biologiska processer. "Det vi kan göra för detta utsökt enkla modellsystem är i princip tillämpligt på mycket mer komplexa modeller," sa Mahamid. "Till exempel, i vår grupp studerar vi interaktionen mellan virus och deras mänskliga cellvärd, organisationen av mänskliga pluripotenta stamceller och funktionen av deras ribosomer, och även stora flercelliga 3D-organoider som våra medarbetare och vi odlar från celler hämtade direkt från cancerpatienter." + Utforska vidare