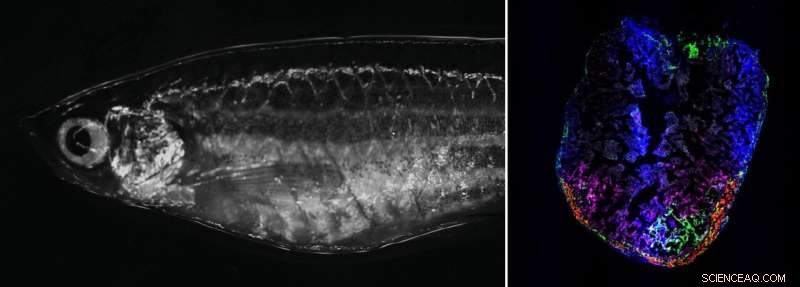
Till höger:Vuxen zebrafisk i ljusfältsmikroskopet. Till vänster:Zebrafiskhjärta 7 dagar efter kryoskada. Övergående aktiverade fibroblaster lokaliseras till skadeområdet. Kredit:Panáková Lab, MDC
En MDC-forskargrupp ledd av Jan Philipp Junker och Daniela Panáková har funnit att zebrafisk kan regenerera hjärtvävnad efter skada. Bindvävsceller spelar en viktig roll i processen genom att tillfälligt gå in i ett aktiverat tillstånd, som teamet rapporterar i Nature Genetics .
När en person drabbas av en hjärtinfarkt och inte får behandling tillräckligt snabbt, skadas hjärtmuskelceller (kardiomyocyter) av syrebrist och börjar dö ut. Det bildas då ärrvävnad och eftersom vi inte kan producera nya kardiomyocyter kan hjärtat inte längre pumpa så bra som det borde. Saker och ting är väldigt annorlunda hos lägre ryggradsdjur som zebrafisken, som kan regenerera organ – inklusive hjärtat.
"Vi ville ta reda på hur den här lilla fisken gör det, och om vi kunde lära oss av det", säger professor Jan Philipp Junker, chef för Quantitative Developmental Biology Lab vid Berlin Institute for Medical Systems Biology (BIMSB), en del av Max Delbrück Center for Molecular Medicine i Helmholtz Association (MDC) i Berlin. I samarbete med Dr Daniela Panáková, som leder laboratoriet för elektrokemisk signalering inom utveckling och sjukdom vid MDC, simulerade forskarna hjärtinfarktskador i hjärtat på deras zebrafiskar. Med hjälp av encellsanalyser och cellinjeträd spårade de regenereringen av kardiomyocyterna. De har nu publicerat sina observationer i tidskriften Nature Genetics .
Människans hjärtan stannar vid förnyelse
Forskarna började med att hålla en kall nål mot zebrafiskens en millimeter stora hjärta i några sekunder under ett mikroskop. Nålen dödar all vävnad den vidrör. Precis som hos mänskliga hjärtinfarktspatienter orsakar detta ett inflammatoriskt svar, som följs av ärrbildning från bindvävsceller som kallas fibroblaster. "Överraskande nog är det omedelbara svaret på skadan väldigt likt. Men medan processen hos människor stannar vid den tidpunkten fortsätter den i fisken. De bildar nya kardiomyocyter som kan dra ihop sig", säger Junker.
"Vi ville identifiera signalerna som kommer från andra celler och hjälpa till att driva regenereringen", fortsätter han. Junkers team använde encellsgenomik för att söka i det skadade hjärtat efter celler som inte finns i ett friskt zebrafiskhjärta. De hittade tre nya typer av fibroblaster som tillfälligt går in i ett aktiverat tillstånd. Även om de är externt identiska med de andra fibroblasterna, kan dessa aktiverade celler läsa en hel serie ytterligare gener som är ansvariga för att bilda proteiner – som bindvävsfaktorer som kollagen 12.
Fibroblaster ger signalen för regenerering
Hos människor ses ärrbildning (eller fibros) som ett hinder för att regenerera hjärtat. Men fibroblasterna verkar vara viktiga för processen så snart de går in i sitt tillfälligt aktiverade tillstånd. Hur viktiga de är blev tydligt när Panáková använde ett genetiskt knep för att stänga av de kollagen 12-uttryckande fibroblasterna i zebrafisken. Resultatet:ingen regenerering. Junker anser att det är vettigt att fibroblaster är ansvariga för att ge reparationssignalerna:"De bildas trots allt precis vid skadeplatsen", säger han.
För att identifiera källan till dessa aktiverade fibroblaster producerade Junkers team cellinjeträd med hjälp av en teknik som heter LINNAEUS, som hans labb utvecklade 2018. LINNAEUS arbetar med genetiska ärr som tillsammans fungerar som en streckkod för ursprunget till varje cell. "Vi skapar den här streckkoden med CRISPR-Cas9 genetisk sax. Om två celler efter skada har samma streckkodssekvens betyder det att de är släkt", förklarar Junker. Forskarna identifierade två källor till tillfälligt aktiverade fibroblaster:det yttre lagret av hjärtat (epicardium) och det inre lagret (endokardium). Celler som producerar kollagen 12 hittades uteslutande i epikardium.
Olika discipliner samarbetade nära med studien
Flera MDC-forskare samarbetade under hela studien - från experimenten på fisken, till de genetiska analyserna, till den bioinformatiska tolkningen av resultaten. "För mig var det mest spännande att se hur väl våra discipliner kompletterar varandra och hur vi kunde verifiera resultat från bioinformatik på ett levande djur", säger Sara Lelek, som är huvudförfattare till studien och ansvarade för djuret. tester. "Det var ett stort projekt som gjorde att vi alla kunde bidra med vår expertis. Jag tror att det är därför studien är så omfattande och så användbar för många forskare."
Dr. Bastiaan Spanjaard, även huvudförfattare, håller med:"Eftersom vi hade så olika expertområden var vi ofta tvungna att förklara våra experiment och analyser för varandra. Hjärtförnyelse är en komplex process som påverkas av många olika saker. Experimenten producerade enorma mängder data. Att filtrera de korrekta biologiska signalerna från dem var enormt utmanande."
Det är fortfarande oklart om skadade hjärtan hos däggdjur som människor och möss saknar de nödvändiga signalerna eller förmågan att läsa signalerna. Om signalerna saknas kan medicin så småningom utvecklas för att simulera dem. Men, säger Junker, att hitta ett sätt att efterlikna signaltolkning skulle vara mycket svårare.
Fibroblaster hjälper också till att bilda nya blodkärl
Forskarna vill nu titta närmare på de gener som de tillfälligt aktiverade fibroblasterna läser särskilt ofta. De vet att många av generna i fråga är viktiga för att frigöra proteiner i det omgivande området. Och dessa kan inkludera faktorer som också påverkar kardiomyocyter. Och första bevis tyder på att de aktiverade fibroblasterna inte bara främjar förnyelsen av hjärtat; de hjälper också till att bilda nya blodkärl som förser hjärtat med syre.