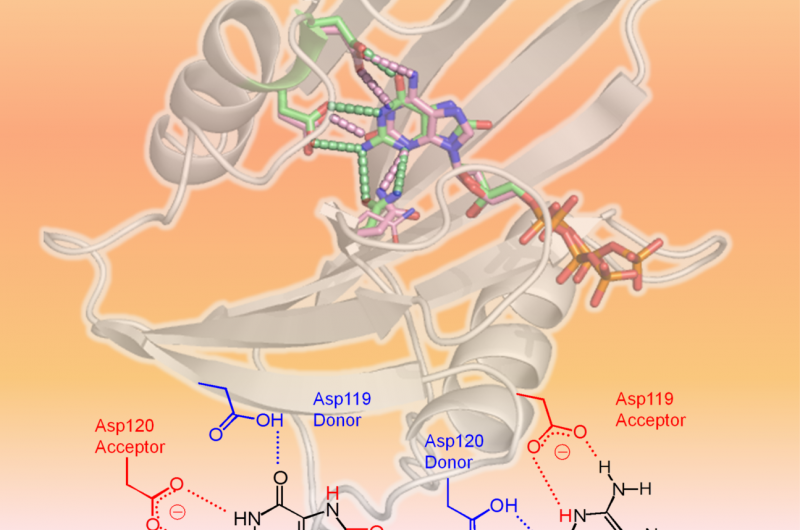
hMTH1 känner igen två oxiderade dNTP som visas i 3D-strukturen (övre delen av figuren:hMTH1, band; skadade dNTP:er, pinnar). Den avgörande faktorn i den breda substratspecificiteten är olika protonationstillstånd mellan Asp-119 och Asp-120 (nedre delen av figuren). Kredit:Professor Yuriko Yamagata
Humant MutT homolog 1 (hMTH1) protein fungerar som det primära enzymet för att bryta ner (hydrolysera) skadade (oxiderade) deoxinukleosidtrifosfater (dNTP) substraten för DNA-syntes. Nyligen, hMTH1 har uppmärksammats som ett populärt mål för nya cancerterapier eftersom det inte är nödvändigt för normala celler, men cancerceller kräver det för att undvika att införliva oxiderade nukleotider i DNA, vilket skulle leda till cancercellsdöd. Nu, hMTH1-hämmare utvecklas som läkemedelskandidater mot cancer. Även om vissa rapporter argumenterar mot användbarheten av hMTH1-hämning, mycket potenta och selektiva hMTH1-hämmare, vilket skulle möjliggöra införandet av oxiderade nukleotider i cancercells-DNA, förväntas för framtida cancerbehandling.
Enzymer är vanligtvis mycket noggranna med det material de katalyserar (substrat). Vissa, dock, kan katalysera mer än ett substrat, och hMTH1 är känt för att hydrolysera flera oxiderade dNTP. Orsakerna bakom den breda substratspecificiteten hade ännu inte utforskats när forskare från Japan började överväga frågan.
Forskare från Kumamoto University, National Institutes for Quantum and Radiological Science and Technology, och Kyushu University utförde strukturella och kinetiska analyser på hMTH1 för att bestämma mekanismerna bakom dess förmåga att hydrolysera olika oxiderade mutagena dNTP, såsom 8-oxo-dGTP och 2-oxo-dATP, med liknande effektivitet. Deras experiment fann bevis för att protonationstillståndet mellan aspartatresterna Asp-119 och Asp-120 var den avgörande faktorn för hMTH1:s breda substratspecificitet. Med andra ord, tillägget eller avlägsnandet av en eller flera protoner vid Asp-119 eller Asp-120 är det som gör att hMTH1 känner igen 8-oxo-dGTP eller 2-oxo-dATP. Detta tillåter hMTH1 att hydrolysera de oxiderade mutagena dNTP:erna innan de används för DNA-syntes; DNA som innehåller oxiderade nukleotider skulle orsaka cancercellsdöd.
"Vi fann att olika protonationstillstånd mellan Asp-119 och Asp-120 är signalen för hMTH1 att hydrolysera de skadade nukleotiderna. Om denna verkan av hMTH1 kan undertryckas, cancerceller skulle ackumulera skadade nukleotider och så småningom genomgå apoptos, " sa Kumamoto Universitys professor Yuriko Yamagata, ledare för forskargruppen. "Förtydligandet av denna mekanism bör hjälpa till vid utvecklingen av hMTH1-inriktade läkemedel mot cancer."