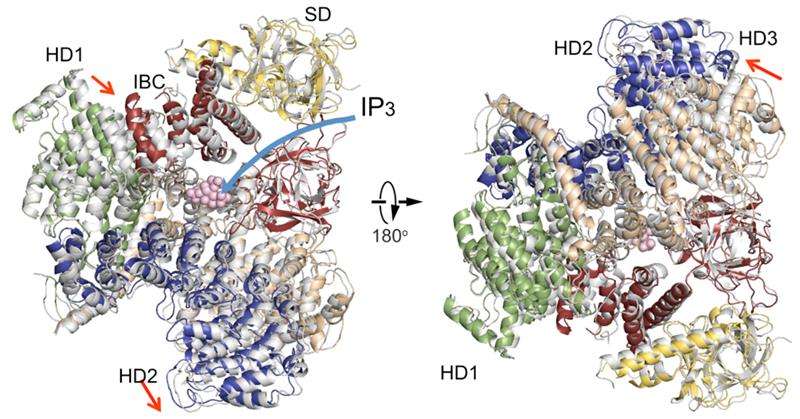
En jämförelse av IP3R cytosoliska domänstrukturer i frånvaro av IP3 (färgad) med en i närvaro av IP3 (grå). Domänorganisation. Undertryckardomän (SD), gul; IP3-bindande kärna (IBC), röd; spiralformad domän 1 (HD1), grön; spiralformad domän 2 (HD2), blå; spiralformad domän 3, vete. Kredit:RIKEN
Forskare vid RIKEN Brain Science Institute har bestämt atomupplösningsstrukturen för en nyckelmolekyl som översätter signaler från en cells lokala miljö till ett språk som cellen kan förstå och använda. Bestämningen av arkitekturen för Inositol Tris-fosfatreceptorn (IP3R) hade länge ansetts vara ett viktigt mål inom biomedicinsk forskning på grund av dess strategiska roll inuti celler som en molekylär tågstation för att överföra signaler som styr många cellfunktioner.
Kulminerande en nästan 10 år lång insats, forskare har bestämt atomupplösningsstrukturen för en nyckelmolekyl som översätter signaler från en cells lokala miljö till ett språk som cellen kan förstå och använda. Bestämningen av arkitekturen för Inositol Tris-fosfatreceptorn (IP3R) hade länge ansetts vara ett viktigt mål inom biomedicinsk forskning på grund av dess strategiska roll inuti celler som en molekylär tågstation för att överföra signaler som styr många cellfunktioner. Strukturen förväntas bidra till utvecklingen av bättre terapeutiska metoder för många sjukdomar. Arbetet utfördes av ett team vid RIKEN Brain Science Institute under ledning av professor Katsuhiko Mikoshiba, vars laboratorium klonade den första IP3R-genen 1989.
I alla levande celler, kemiska signaler utnyttjas för intracellulär kommunikation. Inositol 1, 4, 5-trisfosfat (IP3) är en sådan signal som binder till IP3-receptorn (IP3R) för att frigöra kalciumjoner (Ca2+) från intracellulära Ca2+-depåer såsom det endoplasmatiska retikulumet. De IP3R-inbäddade Ca2+-lagren är distribuerade i olika mikrodomäner inom celler och har centrala roller i så olika processer som neural kommunikation, differentiering, formbarhet, och metabolism. Av de tre gener som identifierats, den hjärndominanta typ 1 IP3R (IP3R1) är genetiskt orsak till spinocerebellär ataxi 15/16/29 och Gillespies syndrom, och reglerar cellulära avfallshanteringsprocesser som är inblandade i etiologin för neurodegenerativa sjukdomar inklusive Alzheimers sjukdom. Även om de viktiga rollerna för IP3R i normala och sjukdomstillstånd är välkända, Det var svårt att förstå hur IP3-signaler utlöser öppningen av Ca2+-kanalen.
Den nya IP3R1-kristallstrukturen avslöjar ett rikt kosmos av detaljer i atomskala om dess funktion. IP3R1 är en mikromaskin på 20 nm i diameter som innehåller två funktionella understrukturer, ett IP3-bindningsställe och en Ca2+-kanalpor. Avståndet från IP3-bindningsstället till kanalporen är 7 nm, den längsta bland liknande jonkanaler, och den grundläggande frågan om hur IP3-bindning fysiskt öppnar kanalen från ett långt håll har varit obesvarad under decennierna sedan genen klonades. Röntgenkristallografi av den stora cytosoliska domänen av en mus IP3R1 i frånvaro och närvaro av IP3, på RIKEN SPring-8 jonstrålefabriken, identifierade en mekanism med lång räckvidd som involverar en IP3-beroende global rörelse av en del av receptorn som kallas den krökta α-helixdomänen som fungerar som en brygga mellan cytosol- och kanaldomänerna. Mutagenes av denna brygga avslöjade den väsentliga rollen för en broschyrstruktur i den α-spiralformade domänen som vidarebefordrar IP3-signaler till kanalen, och kan hjälpa till att förklara hur långdistanskoppling från IP3-bindning till Ca2+-kanalen sker.
Fynden avslöjar likheter och skillnader med en nyligen publicerad rapport om IP3R med en helt annan metod som kallas kryo-elektronmikroskopi. I den relaterade studien, en grupp ledd av Irina Serysheva från University of Texas Health Science Center i Houston föreslog att kanalaktivering av IP3 kan ske genom direkt bindning av C-terminalen och IP3-bindande domänen och koppling från den IP3-bindande domänen till angränsande subenheter. De nuvarande uppgifterna stämmer inte överens med dessa slutsatser, istället föreslår att IP3-bindningsstället till broschyrregionen ligger bakom de dynamiska strukturella förändringarna av IP3. En jämförelse av de två strukturerna avslöjar överensstämmelse på en orörlig del av den krökta spiraldomänen och ett variabelt arrangemang av andra spiralformade domäner. Författarna antar att den orörliga sektionen skulle fungera som en stel kropp som leder ett vridmoment från IP3-bindande platser till kanaldomänen, medan de flexibla regionerna skulle bidra till de dynamiska egenskaperna hos IP3R-funktionen.
Att lösa det långvariga mysteriet med långdistanskommunikation som tillåter IP3 att öppna kanalen kommer att underlätta framtida rationell läkemedelsdesign riktad mot receptorn som skulle kunna möjliggöra ett mer varierat utbud av terapeutiska vägar. Fynden kan också klargöra IP3R-roller i cellulär senescens och tumörundertryckning kopplat till selektiv sårbarhet hos cancerceller. Förvånande, studien klargör också en roll för IP3R i funktionen av patogena encelliga organismer som Trypanosoma cruzi, parasiten av Chagas sjukdom, och brucei, som orsakar afrikansk trypanosomiasis eller sömnsjuka. Teamet identifierade en aminosyrasekvens i broschyren som är konserverad i parasiter, föreslår strukturella insikter som kan hjälpa till att upptäcka läkemedel för dessa förödande tillstånd.