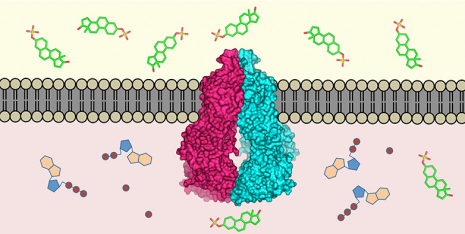
Transportproteinet ABCG2 (mitten) är inbäddat i cellmembranet. Den känner igen över 200 ämnen i cellens inre (nedan) och transporterar dem utanför (ovan). Kredit:ETH Zürich / Scott Jackson, Ioannis Manolaridis, Kaspar Locher
Transportproteiner i kroppens celler skyddar oss från särskilda gifter. Forskare vid ETH Zürich och universitetet i Basel har nu bestämt den högupplösta tredimensionella strukturen hos ett stort mänskligt transportprotein. I längden, detta kan hjälpa till att utveckla nya mediciner.
Nästan alla levande varelser har utvecklat mekanismer för att ta bort gifter som har kommit in i deras celler:molekylära pumpar som finns i cellmembranet känner igen skadliga ämnen i cellens inre och transporterar dem utanför. Forskare från ETH Zürich och Biozentrum vid universitetet i Basel har nu definierat den tredimensionella strukturen för ett sådant transportprotein hos människor (proteinet ABCG2) på atomnivå. Detta är första gången en sådan struktur har definierats för en mänsklig multidrogtransportör. Forskarna publicerade sitt arbete i det senaste numret av den vetenskapliga tidskriften Natur .
"Proteinet ABCG2 känner igen och transporterar minst 200 kända ämnen, " förklarar Kaspar Locher, Professor i molekylär membranbiologi vid ETH Zürich och chef för studien. Dessa ämnen inkluderar alkaloider – växtämnen som vi får i oss med vår mat – men också ämnen som kroppen själv producerar, såsom urinsyra eller bilirubin (en metabolit av hemoglobin).
Proteinet är aktivt i tarmväggen, till exempel, där det förhindrar att skadliga ämnen kommer in i blodet; det finns också i cellerna i blod-hjärnbarriären, där det håller gifter borta från hjärnan. Proteiner som ABCG2 spelar också en viktig roll i bröstkörtlarna och i moderkakan, där de säkerställer att gifter inte kommer in i bröstmjölken eller blodomloppet hos ett ofött barn.
Dubbeleggat svärd
Rollen av multidrogtransportörer har en baksida, dock:proteinerna pumpar också ut vissa mediciner ur cellerna, hindrar dem från att verka i dessa celler. "Detta betyder att när man utvecklar mediciner, det är alltid viktigt att undersöka om de känns igen av transportproteiner som ABCG2, " säger Locher. Läkemedel som administreras oralt måste penetrera tarmväggen, och de som är avsedda för hjärnan måste passera blod-hjärnbarriären – vilket de bara kan göra om ABCG2 inte känner igen dem.
Det är välkänt, dock, att ABCG2 känner igen vissa cancerläkemedel (kemoterapeutika). Detta är särskilt allvarligt eftersom vissa tumörceller kan öka antalet ABCG2-proteiner i sina cellmembran. Sådana celler pumpar effektivt det kemoterapeutiska ämnet utåt – vilket betyder att de är resistenta mot läkemedlet.
Utveckla läkemedel med datorer
Nu när forskare känner till strukturen för ABCG2, i framtiden kanske de kan simulera på en dator om nya läkemedel kommer att kännas igen av transportproteinet. Forskare kan också använda datormodellering för att utveckla bättre antikroppar för diagnos av läkemedelsresistenta cancerceller, eller läkemedel som hämmar transportproteinet. Sådana substanser kan hjälpa till att övervinna resistens mot speciella kemoterapeutika. "Bidragen från vår forskning till medicin, särskilt cancermedicin, borde verkligen ses på längre sikt. Vi bygger i första hand grunden, " betonar Locher.
ABCG2 är en mycket mobil molekyl, vilket gjorde det svårt att bestämma dess atomära struktur. Genom att använda stabiliserande antikroppar, dock, forskarna lyckades immobilisera proteinet. Den tredimensionella strukturen bestämdes med hjälp av kryo-elektronmikroskopi av ETH-forskarna i samarbete med Henning Stahlberg, en professor vid Biozentrum vid universitetet i Basel, och hans grupp. "Vi har nyligen arbetat intensivt med att optimera upplösningskapaciteten i våra elektronmikroskop, och avsevärt automatisera dem samtidigt. Detta har nu resulterat i en otroligt snabb strukturbestämningspipeline, säger Stahlberg.
Kryoelektronmikroskopi är en jämförelsevis ny teknik för att bestämma atomära molekylära strukturer. "Den här tekniken har utlöst en revolution inom strukturbiologin, " säger Locher. Med tanke på dess betydelse, ETH Zürich kommer att fortsätta att investera i metoden och kommer att förvärva ett andra avancerade kryoelektronmikroskop för mikroskopicentret ScopeM. Det kommer att vara tillgängligt för alla biovetenskapsforskare att studera molekyler och strukturer med atomär upplösning.