
För första gången har forskare fångat cellmaskineriet som gör en livsviktig molekyl i processen att utvecklas. Ett nyckelenzym som växter använder för att göra tyrosin, en aminosyra som är nödvändig för livet, ansågs vara bevarad över hela växtriket men forskarna fann att den har muterats till en annan form i baljväxter. I körsbärstomater dominerar den kanoniska formen av enzymet, jordnötter kan byta hit och vissa stammar av sojabönor (klumpiga bönor till höger) har förlorat den kanoniska formen. Kredit:Jez Lab
Eftersom växter inte kan resa sig och fly, de har fått vara smarta istället. De är den levande världens kemister, producerar hundratusentals små molekyler som de använder som solskyddsmedel, att förgifta växtätare, att dofta luften, att färga blommor, och för mycket annan hemlig vegetativ verksamhet.
Historiskt sett är dessa kemikalier, kallas "sekundära metaboliter, " har särskiljts från "primära metaboliter, "som är byggstenarna i proteiner, fetter, sockerarter och DNA. Sekundära metaboliter jämnar ut livet men de primära metaboliterna är viktiga, och misslyckandet med att göra dem korrekt och effektivt är ödesdigert.
Sekundär metabolism tros ha utvecklats för att hjälpa växternas förfäder att hantera att leva på torra land snarare än de mer gästvänliga haven. Tanken är att generna för enzymer i de molekylära sammansättningslinjerna för primär metabolism duplicerades. Duplikaten var mer toleranta mot mutationer som kan ha destabiliserat de primära vägarna eftersom originalen fortfarande var på jobbet. Med evolutionära begränsningar på så sätt avslappnade, syntetiska maskiner kunde ackumulera tillräckligt många mutationer för att göra ny kemi.
Primär metabolism, dock, är allmänt bevarad, vilket innebär att det förblir oförändrat över många olika grupper av organismer eftersom det har finjusterats för att fungera korrekt och effektivt och eftersom dess produkter är nödvändiga för livet. Eller så säger läroböckerna.
Men nu har ett samarbetande team av forskare fångat den primära metabolismen i färd med att utvecklas. I en omfattande studie av ett löpande band för primärmetabolism i växter, de upptäckte ett nyckelenzym som utvecklades från en kanonisk form som innehas av de flesta växter, genom icke-kanoniska former i tomater, till en strömbrytare som finns i jordnötter, och slutligen förbinder sig till den nya formen i vissa stammar av sojabönor.
Denna bedrift, jämförbart med att dra ut duken under disken utan att någon av dem går sönder, beskrivs i numret 26 juni av Naturens kemiska biologi . Det är ett samarbete mellan Maeda-labbet vid University of Wisconsin, som har ett långvarigt intresse för denna biokemiska väg, och Jez-labbet vid Washington University i St. Louis, som kristalliserade sojabönsenzymet för att avslöja hur naturen förändrade hur proteinet fungerar.
"Arbetet fångar växter i färd med att bygga en väg som länkar den primära till den sekundära metabolismen, sade Joseph Jez, Howard Hughes Medical Institute professor vid Institutionen för biologi inom konst och vetenskap. "Vi ser äntligen hur evolutionen skapar maskineriet för att göra nya molekyler."
Det kan också ha praktisk betydelse eftersom de gamla och de nya vägarna gör aminosyran tyrosin, som är en prekursor för många sekundära metaboliter med biologisk och farmaceutisk aktivitet – allt från vitamin E till opioider. Men den gamla vägen gör bara små mängder av dessa föreningar, delvis för att de måste konkurrera om kolatomer med den giriga processen för att tillverka lignin, de tuffa polymererna som låter växter stå högt.
Upptäckten av den nya vägen för att göra tyrosin är mycket mindre begränsad än den gamla. Detta ökar möjligheten att kolflödet kan ledas bort från lignin, öka utbytet av läkemedel eller näringsämnen till nivåer som gör att de kan produceras i kommersiella kvantiteter.
En berättelse om två enzymer
Tyrosin tillverkas på ett löpande band som kallas shikimate-banan, en sjustegs metabolisk väg som växter använder för att göra de tre aminosyrorna som har aromatiska ringar. Djur (inklusive människor) förlorade förmågan att uppföra detta löpande band djupt i det evolutionära förflutna. Eftersom vi inte kan tillverka dessa aminosyror på egen hand och de är viktiga för livet, vi måste istället få dem genom att äta växter eller svampar.
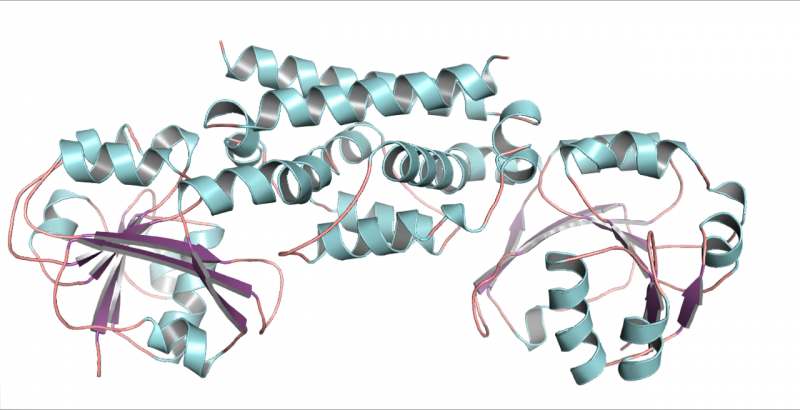
En tredimensionell struktur av PDH-enzymet från sojabönor, en baljväxt. Denna struktur hjälpte till att visa att endast en mutation tillät baljväxter att utveckla ett nytt sätt att göra aminosyran tyrosin. Kredit:Craig Schenck
Den aromatiska ringen är viktig, sa Jez, eftersom det är en distinkt struktur som kan absorbera ljus eller energi. Så de aromatiska aminosyrorna är också prekursorerna för många sekundära metaboliter som fångar ljus, överföra elektroner, eller färga blommor. Dessutom, de aromatiska aminosyrorna är också prekursorer för kemikalier som förgiftar andra växter eller växtrovdjur och attraherar pollinatörer. Många läkemedel inkluderar en aromatisk ring, Jez kommenterade.
I de flesta växter finns shikimatvägen i kloroplasten, organellen som gör jobbet med att omvandla solljusets energi till energi lagrad i kolbindningar. En gång gjort, dock, tyrosin kan exporteras ut ur cytosolen för inkorporering eller omvandling till andra föreningar.
I det sista steget av en gren av vägen ett enzym som kallas arogenatdehydrogenas (ADH), katalyserar en reaktion som gör att föreningen arogeneras till tyrosin. ADH-enzymet anses vara "reglerande" eftersom det är en flaskhals i tyrosinproduktionen. Det måste konkurrera om arogenatsubstratet med grenen av shikimatvägen som gör en annan aromatisk aminosyra och det hämmas starkt av uppbyggnaden av tyrosin
ADH-aktivitet är vanlig i växter, men under loppet av att studera shikimate-vägen upptäckte Maeda-labbet att DNA-sekvenserna som kodar för ADH i vissa blommande växter skilde sig markant från dem i de flesta växter. De kallade enzymerna som produceras av dessa sekvenser för icke-kanoniska ADH. Sedan, under 2014, de rapporterade att vissa baljväxter också gör tyrosin med ett annat enzym, kallas prefenatdehydrogenas (PDH).
PDH skiljer sig från ADH på många sätt. Det är aktivt utanför kloroplasten, det verkar på substratet prefenat snarare än på arogenat, eftersom det är utanför kloroplasten behöver det inte konkurrera om sitt substrat med andra grenar av shikimatvägen, och det hämmas inte av stigande nivåer av tyrosin.
Varför finns det två olika monteringslinjer för tyrosin? Forskarna tror att PDH-enzymet utvecklats via två gendupliceringshändelser och ackumuleringen av mutationer i de "extra" kopiorna av genen. Den första händelsen gav upphov till icke-standardiserade ADH i vissa blommande växter och den andra till PDH i en undergrupp av baljväxter. Men varför hände detta?
Det är inte en fråga som forskarna kan svara på än, förutom i allmänna termer, sa Jez. Det som sticker ut, dock, är att den mer nyligen utvecklade metaboliska vägen inte är strikt reglerad och kan potentiellt bryta ut produkten i en hektisk takt. Kanske var baljväxterna i stort behov av sekundära metaboliter av någon anledning. Det är verkligen misstänkt att baljväxter har en helt annan ekologi än andra växters, eftersom de lever symbiotiskt med kvävefixerande bakterier.
Pillar med bitarna
Vid det här laget visste forskarna att det nya enzymet, PDH, bundit ett annat substrat än det ursprungliga enzymet, ADH. De visste också att PDH, till skillnad från ADH, binder inte tyrosin själv. Men vilka förändringar i struktur ledde till dessa skillnader i kemisk aktivitet?
Att få reda på, Craig Schenck, en doktorand i Maeda-labbet, jämförde gensekvenserna för ADH- eller PDH-enzymet i många olika växter, noggrant utvalda för att vara på gränsen för övergången från ett enzym till det andra. Men de stötte på ett problem. Det fanns tillräckligt många skillnader i DNA för att det var svårt att se vad som var relevant, sa Jez.
Möte Maeda på en konferens, Jez erbjöd sig att försöka kristallisera de nya enzymerna så att deras struktur kunde rekonstrueras från röntgenbilder. Hans doktorand Cynthia Holland kunde kristallisera sojabönans PDH och producera detaljerade bilder av dess tredimensionella form.
"När du tittade på strukturen kunde du se att det bara fanns två skillnader från den typiska ADH som finns i de flesta växter och bara en av skillnaderna ändrade faktiskt saker, " Sa Jez. Häpnadsväckande nog var den skillnaden en enda aminosyra i det aktiva stället på enzymet. På den platsen hade asparaginen ersatt asparaginsyra.
Schenck dubbelkontrollerade denna strukturella insikt genom att vända den aminosyran i muterade former av enzymet. ADH-mutanten visade sig ha PDH-aktivitet, och PDH-mutanten hade ADH-aktivitet, precis som teamet hade misstänkt.
"Denna skillnaden förändrar enzymets föredragna substrat och dess förmåga att hämmas av tyrosinåterkoppling, " Sa Jez. "Och om du tittar på det, det är bokstavligen skillnaden mellan en kväveatom eller en syreatom. I dessa proteiner, som består av nästan trehundra aminosyror eller fyrtiotvåhundra atomer, en atom gör hela skillnaden. Det är bara lite coolt."
Arbetet är viktigt eftersom det visar att primär metabolism utvecklas. Och för att det visar hur naturen stjäl maskiner från primär metabolism och klappar ihop det för att göra nya sekundära metaboliter. De gör detta med mycket mer finess än vad gentekniker ännu kan hantera.
"När vi vill att en växt ska göra en ny molekyl, "Jez sa, "vi släpper in en gen och hoppas att den integreras med befintliga vägar. Vi vet fortfarande inte hur vi enkelt ska kunna koppla ledningarna mellan det vi faller in och det som redan finns där. Så det är intressant att se hur naturen lyckades koppla ihop ledningarna och ändra saker utan att gå sönder dem."