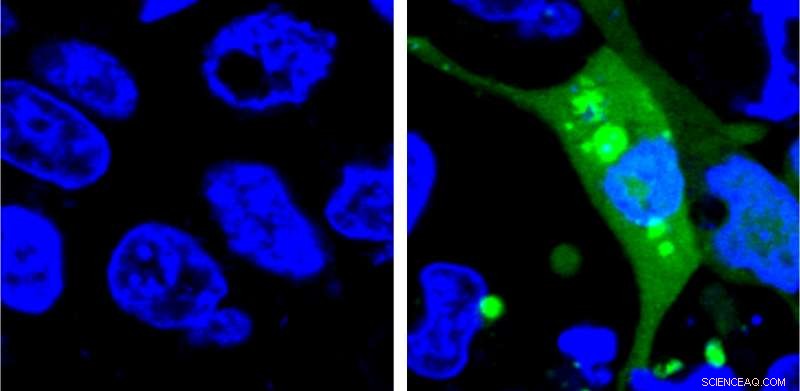
Bild av celler som uttrycker AgHalo-sensorn före (vänster) och efter (höger) cellulär stress. AgHalo-sensorn slås på när felveckade proteiner börjar aggregera och ger ett kvantitativt mått på cellulär stress som kan användas för att utvärdera läkemedelssäkerhet. Kredit:Yu Liu, Penn State University
En ny teknik för att utvärdera läkemedelssäkerhet kan upptäcka stress på celler i tidigare skeden än konventionella metoder, som mest förlitar sig på att upptäcka celldöd. Den nya metoden använder en fluorescerande sensor som slås på i en cell när felveckade proteiner börjar samlas - ett tidigt tecken på cellulär stress. Metoden kan anpassas för att detektera proteinaggregat orsakade av andra toxiner, samt sjukdomar som Alzheimers eller Parkinsons. En artikel som beskriver den nya metoden, av ett team av forskare vid Penn State University, dyker upp i journalen Angewandte Chemie International Edition .
"Läkemedelsinducerad proteinstress i celler är en nyckelfaktor för att bestämma läkemedelssäkerhet, sa Xin Zhang, biträdande professor i kemi och i biokemi och molekylärbiologi vid Penn State, tidningens seniorförfattare. "Droger kan få proteiner – som är långa strängar av aminosyror som måste vikas exakt för att fungera ordentligt – att felveckas och klumpas ihop till aggregat som så småningom kan döda cellen. Vi satte igång att utveckla ett system som kan detektera dessa aggregat vid mycket tidiga stadier och som också använder teknik som är överkomlig och tillgänglig för många laboratorier."
Det nya systemet är det första som använder en fluorescerande sensor som inte slås på förrän de felveckade proteinerna börjar aggregera. Forskarna designade ett instabilt protein – kallat AgHalo – som är märkt med ett speciellt fluorescerande färgämne som blir aktivt i en hydrofob, dvs vattenavvisande, miljö. Hydrofoba delar av proteiner är vanligtvis begravda djupt i strukturen av ett ordentligt vikt protein eftersom miljön i cellen till största delen är vatten. När AgHalo-proteinet börjar felveckas och aggregeras kan färgämnet interagera med de hydrofoba delarna av proteinet och börja fluorescera.
Tidigare system använde sensorer som alltid var på. Cellerna skulle ha en allmän diffus fluorescens före någon stress och systemen kunde bara detektera proteinstress när de felveckade proteinerna aggregerade, bildar ljusare fläckar av fluorescens som var tillräckligt stora för att kunna ses under ett mikroskop.
"En ytterligare fördel med vårt system är att nivån av fluorescens är korrelerad till mängden proteinaggregation i cellen, så vi kan kvantifiera nivån av stress" sa Yu Liu, en postdoktor vid Penn State och den första författaren till artikeln. "Också, eftersom vår metod mäter nivån av fluorescens, istället för att behöva identifiera fluorescensen under ett mikroskop, det kan göras med mer tillgänglig teknik, som tallrikläsare, och det är mycket mer hög genomströmning."
Forskarna använde sin sensor för att testa nivån av proteinstress orsakad av fem vanligt använda läkemedel mot cancer. Även om ingen av drogerna de testar orsakar signifikant celldöd i tidigare drogsäkerhetstester, alla fem producerade en viss nivå av proteinstress som kunde detekteras av AgHalo-sensorn.
"Eftersom vi testade anticancerläkemedlen i mycket högre doser än vad som vanligtvis används för behandling, våra resultat ifrågasätter inte nödvändigtvis den fortsatta användningen av dessa droger, " sa Liu. "Men, eftersom proteinstress från långvariga behandlingar kan ha bestående effekter, att utvärdera läkemedel med vår nya sensor kommer att hjälpa till att utveckla säkrare läkemedel."
Proteinstress kan induceras av många andra faktorer. Värme, gifter, bakteriella infektioner, cancer, och även åldrande kan orsaka att proteiner felveckas och bildar aggregat i celler. "Med vår metod, vi kan kvantitativt upptäcka proteinstress i celler i mycket tidigare skeden och därför kan forskare börja studera de mekanismer som celler använder för att bekämpa denna stress och utveckla föreningar som kan förbättra cellens förmåga att hantera proteinstress, " sa Zhang.