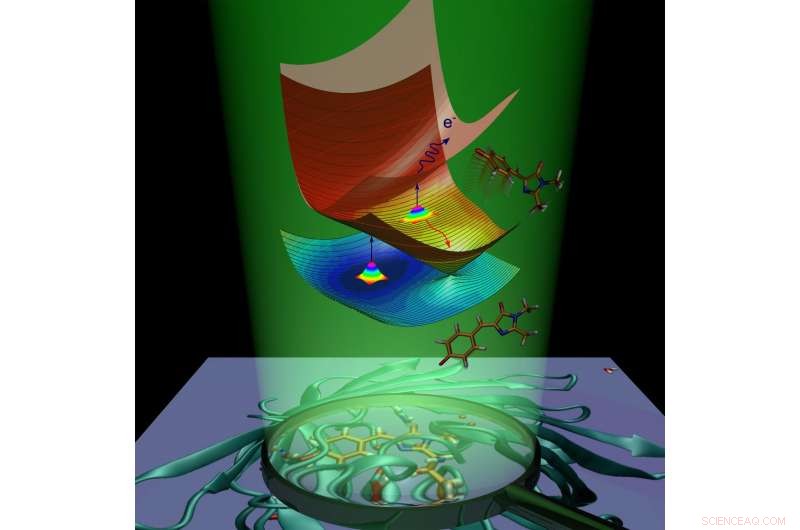
Molekylär dynamik av det gröna fluorescerande proteinet kromofor orsakat av ljusabsorption. Upphovsman:Anastasia Bochenkova
Forskare vid Lomonosov Moskva statsuniversitet i samarbete med danska molekylära fysiker har avslöjat mekanismen som bestämmer känsligheten för grönt fluorescerande protein för ljusexponering. Forskarna har bevisat att en isolerad kromoforgrupp kan avge ljus utanför proteinmiljön, medan proteinfunktionen är att förbättra dess fluorescerande egenskaper. Resultaten publiceras i Journal of the American Chemical Society .
Proteiner från GFP -familjen används i stor utsträckning som biomarkörer. Med deras hjälp, forskare kunde visualisera biologiska processer som äger rum inuti levande celler. Dessa proteiner används i stor utsträckning inom molekylär och cellulär biologi på grund av deras unika förmåga att fluorescera vid absorption av ljus med en viss våglängd.
Kromoforgrupper, eller kromoforer, är ansvariga för ljusabsorption. Kromoforen består av bara tre aminosyrarester. Tills nu, forskare trodde att proteinmiljön fick sin kromofor att avge ljus under bestrålning. Denna idé stöddes av det faktum att den isolerade kromoforen förlorar sina fluorescerande egenskaper vid proteindaturering, dvs utveckling av proteinet. För första gången, författarna har förutspått och experimentellt bevisat att den isolerade kromoforen också kan fluorescera utanför proteinmiljön, men bara vid vissa temperaturer.
Efter absorption av ljus, det fluorescerande proteinet får extra energi och genomgår övergång till det elektroniskt exciterade tillståndet. Proteinmolekylen strävar efter att återgå till marken genom att bli av med överskottsenergin. Denna process kallas inaktivering och fortsätter på två sätt. Den första är fluorescens. Under transport från det upphetsade tillståndet till grundtillståndet, kromoforen avger energi i form av ljus, och som resultat, proteinet blir lysande.
Det andra sättet kallas icke -strålande avslappning. Under denna process, elektronisk excitationsenergi, överförs till en molekyl vid ljusabsorption, omvandlas till vibrationsenergi från kärnor. Intern omvandling inuti det gröna fluorescerande proteinet följs av en kemisk reaktion-cis-trans-isomerisering av kromoforen (dvs. intramolekylär rotation kring en av dubbelbindningarna inuti molekylen).
När det gäller det anjoniska (negativt laddade) kromoforet för det gröna fluorescerande proteinet, energi kan också överföras till en elektron, som lämnar kromoforen. Kromoforen, som genomgår isomerisering eller förlorar en elektron, tar bort överskott av elektronisk energi och fluorescerar inte. Fluorescens kallas en strålningskanal för avaktivering, medan intern omvandling och elektronemission kallas icke -strålande kanaler. Forskarna har experimentellt använt både icke-strålande kanaler för att studera förfallet i upphetsat tillstånd och återhämtning av den isolerade GFP-kromoforen i grundtillstånd vid olika temperaturer.
Forskarna har visat att den isolerade GFP -kromoforen kan fastna i upphetsat tillstånd på grund av närvaron av inneboende energibarriärer längs de icke -strålande inaktiveringsvägarna. När kromoforen kyls till 100 K, infångningen varar i nanosekunder, vilket möjliggör den långsamma strålningskanalen. Infångningsbarriärerna hindrar kromoforen från att återgå till grundtillståndet genom snabb icke -strålande omvandling och får molekylen att fluorescera.
Kemisten Anastasia Bochenkova vid Lomonosov Moscow State University säger, "GFP -kromoforen är inneboende fluorescerande. Interaktioner mellan kromoforgruppen och den närmaste proteinmiljön förbättrar förutsättningarna för att fånga kromoforen i det upphetsade tillståndet, vilket förstärker den molekylära fluorescensen. Som ett resultat, strålningskanalen blir dominerande inuti proteinet redan vid rumstemperatur. "
Forskarna har studerat kromoforegenskaperna både teoretiskt och experimentellt. Forskarna utarbetade en teoretisk modell och uppskattade livslängden för den isolerade kromoforen i upphetsat tillstånd, baserat på kvantkemiska beräkningar på hög nivå. Sådana beräkningar kräver högpresterande datorresurser, och forskarna använde Lomonosov Supercomputing Center för sina studier.
De danska forskarna designade och skapade en ny experimentell teknik för att studera ljusinducerad molekylär dynamik av isolerade laddade kromoforer i vakuum-femtosekund pump-sondspektroskopi med 2-D tidsupplösning. Både fördröjningstiden mellan två femtosekundlaserpulser och sönderfallstiden för en viss molekylär verkan varierades. Den nya tekniken löser den ljusinducerade dynamiken i GFP-kromoforen som den sker i olika sönderfallskanaler genom både de upphetsade och malda elektroniska tillstånden, beroende på temperatur. Baserat på resultaten, forskarna har dragit slutsatsen att inhemska GFP -kromoforer i själva verket kan fluorescera utanför proteinmiljön med en nanosekund livstid, stöder fullt ut teoretiska förutsägelser.
Anastasia Bochenkova säger, "Vår forskning syftar till att avslöja molekylära mekanismer för levande system. En grundläggande utmaning är att förstå förhållandet mellan egenskaperna hos ett helt ljuskänsligt biosystem och dess mycket mindre aktiva kromofor, som är kärnan i det molekylära maskineriet. Här, vi har visat att egenskaperna hos en enda kromofor är viktiga för att förstå verkningsmekanismerna för hela GFP -proteinet. Denna kunskap ligger i skärningspunkten mellan fysik, kemi och biologi, och resulterar i en översyn av det rådande paradigmet om proteinmiljöns roll i fluorescensen av GFP -proteinet. Utöver att lösa frågan om ursprunget för GFP:s inneboende fluorescens, arbetet visar att detaljerad molekylär kunskap erhållen genom kvantkemikalkylberäkningar på hög nivå kan användas tillsammans med molekylär teknik för att utforma nya funktionella biomaterial med optimal fotorespons. "