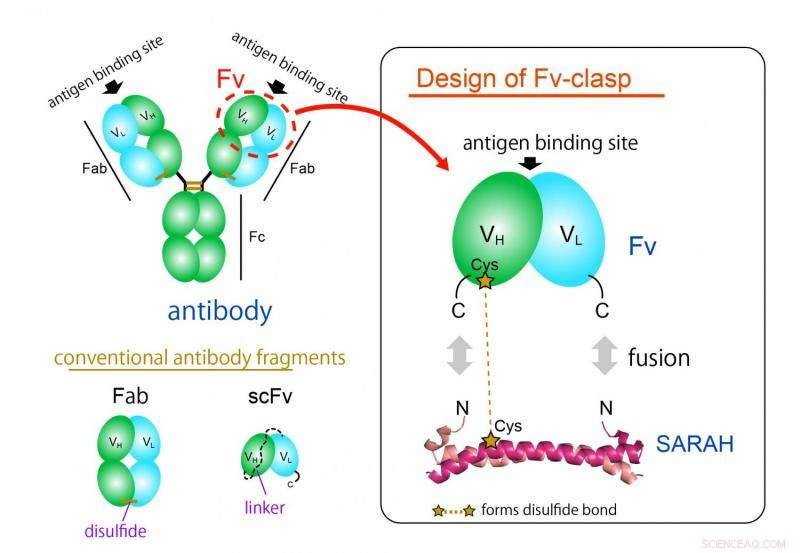
Figur 1. Designkoncept för ett nytt antikroppsfragmentformat "Fv-lås". Fv-lås är en enkel sammansmältning av SARAH-domänen härledd från humant Mst1-protein till Fv (grönt:tung kedja, cyan:lätt kedja) fragment av en antikropp. VH/VL -dimer stabiliseras av dimerkonformationen av SARAH -domänen (mörk och ljus magenta). Upphovsman:Osaka University
Antikroppar är ett kraftfullt vapensystem för att försvara vår kropp mot inkräktare som bakterier och virus. Varje antikropp består av fyra aminosyrapolypeptidkedjor:två tunga kedjor och två lätta kedjor förenade för att bilda en Y-formad molekyl. Antikroppar känner igen ett specifikt antigen som är unikt för dess mål eftersom de besitter de antigenbindande ställena som ligger vid Y:s övre spetsar. Medan antikroppsbaserade läkemedel har fastställts som frontlinjemedicin, lite framsteg har gjorts i användningen av antikroppar som forskningsverktyg för upptäckt av små molekyler, särskilt inom området för röntgenkristallografi.
Röntgenkristallografi är en teknik som använder röntgendiffraktionsmönster för att bestämma högupplöst, tredimensionella strukturer av molekyler som proteiner, små organiska molekyler, och material. Den största utmaningen i röntgenkristallografimetoder är fortfarande produktionen av högkvalitativa diffrakterande kristaller.
Under de senaste åren har det finns en ökande användning av antikroppsfragment som kristallisationskaperoner för att underlätta strukturell bestämning av annars "okristalliserbara" eller "outbrytbara" målproteiner. Grunden för strategin är att öka sannolikheten för att erhålla välordnade kristaller genom att minimera den konformationella heterogeniteten i målproteinet.
Det vanligaste antikroppsfragmentformatet är Fab -formatet, men det är svårt att producera i bakteriella uttryckssystem på grund av dess stora och komplexa struktur. Fv -fragmentet av antikroppen, som endast innehåller en tung och en lätt kedja, skulle vara perfekt för denna applikation tack vare dess enkla och lilla arkitektur. Dock, Fv används sällan eftersom de två kedjorna lätt dissocieras, vilket leder till förlust av funktion.

Figur 2. Kristallstruktur av Fv-lås. Faktisk tredimensionell struktur av Fv-lås bestämd av röntgenkristallografisk analys. Upphovsman:Osaka University
Nu, ett team av forskare vid Osaka universitet har designat ett nytt enkelkedjigt Fv-fragment med förbättrad produktionskompatibilitet, stabilitet och kristalliserbarhet, samtidigt som den ursprungliga molekylens bindningsförmåga bibehålls. De publicerade nyligen sina resultat i Structure.
"Vi lyckades producera ett nytt fragment genom att smälta en antiparallell spolad spiralstruktur härledd från en viss domän hos ett humant enzym, Mst1 kinas, till de antigenbindande ställena i en antikropp, "förklarar studieförfattaren Takao Arimori." Den resulterande chimära molekylen, Fv-lås, var funktionellt och strukturellt ekvivalent med Fv för den ursprungliga antikroppen. "
I synnerhet, byte från Fab till Fv-lås-format förbättrade markant antikroppsassisterad kristallisation av två biologiskt viktiga proteiner, de extracellulära domänerna integrin a6b1 och sorLasorLA. Integrin a6b1 spelar en viktig roll vid fastsättning av iPS -celler och ES -celler samt många levercancerceller till basalmembranet, en extracellulär proteinnätverksgrund som finns i vävnader i de flesta celler och organ, medan sorLA är en proteinreceptor som är inblandad i Alzheimers sjukdom.
"Fv-låsens universella tillämpbarhet på storskalig och billig produktion gör det önskvärt för industriella tillämpningar. Dessutom, dess höga värmestabilitet är en stor fördel för immunterapier, "säger motsvarande författare Junichi Takagi." Bortsett från strukturbiologins område, vi räknar med att Fv-låsdesignen kommer att bidra till expansionen av redan framstående antikroppsanvändning inom både grundläggande och tillämpad vetenskap. "